(1)现有反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g) △H>0。在850℃时,K=1。此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向 方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
下图表示从固体混合物中分离X的两种方案,请回答有关问题。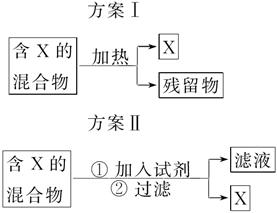
(1)选用方案Ⅰ时,X应该具有的性质是____________,残留物应该具有的性质是__________________;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是________,有关反应的化学方程式为
________________________________________________________________________;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、Al2O3),参照方案Ⅰ和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。
某工厂的废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。现欲从废液中回收乙醇和乙酸,根据各物质的沸点,补充下列实验步骤,模拟实现这一过程,并回答有关问题。
| 物质 |
丙酮(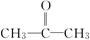 ) ) |
乙酸乙酯 |
乙醇 |
乙酸 |
| 沸点/℃ |
56.2 |
77.06 |
78 |
117.2 |
可供选择的实验用品:
1 mol·L-1烧碱溶液,18.4 mol·L-1硫酸,蒸馏水和冰,400 mL烧杯,250 mL烧杯,250 mL蒸馏烧瓶,温度计,冷凝器,接收器,玻璃棒以及中学化学实验的常用仪器。
(1)补充下列实验步骤:
①组装蒸馏装置,检查气密性;
②取100 mL废液注入250 mL蒸馏烧瓶中,滴入1 mol·L-1烧碱溶液,调至废液pH=10;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
(2)滴入1 mol·L-1烧碱溶液,使溶液的pH=10的目的是
________________________________________________________________________。
(3)用18.4 mol·L-1硫酸的目的是(用化学方程式表示)
________________________________________________________________________。
(4)最后蒸馏烧瓶内残留液中的溶质的主要成分是________。
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示。在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗。为使液体顺利流下,还需插入“空气导入管”与大气相通。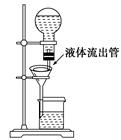
(1)“空气导入管”下口应在________,上口应在________。
| A.滤纸边沿下方 | B.滤纸边沿上方 |
| C.待过滤液液面上 | D.待过滤液中 |
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理。
茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
| 溶剂 |
沸水(100 ℃) |
热水(80 ℃) |
水(25 ℃) |
热乙醇(60 ℃) |
乙醇(25 ℃) |
氯仿(25 ℃) |
乙醚(25 ℃) |
| 溶解度/g |
66.6 |
18.2 |
2 |
4.5 |
2 |
18.2 |
0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶剂中最好的是________(用字母符号填空),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤,再组成提取带结晶水咖啡因的实验操作步骤:______________;______________。
①蒸发浓缩 ②焙炒 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶
在中学化学实验中学过的可用于分离或提纯物质的方法很多,如重结晶、过滤、盐析……请将分离或提纯下列各混合物最适宜方法的名称填到横线上:
①除去生石灰中混有的石灰石:____________。
②除去碘中混有的碘化钠固体:____________。
③除去乙醇中溶解的少量食盐:____________。
④除去Fe(OH)3胶体中混有的Cl-:____________。