请根据题意回答下列 问题:
问题:
Ⅰ、当甲烷的四个氢被甲基替换后,得到新戊烷,新戊烷的所有氢原子再被甲基替换得到新的烷烃,……
(1)请写出甲基电子式 。
(2)新戊烷的三氯代物有 种同分异构体。
(3)试写出甲烷按上述方法连续进行三次甲基替换操作后所得烷烃的分子式
Ⅱ、分子式为C7H16的烃为手性分子,在核磁共振氢谱中有6个吸收峰,则该烃分子的结构简式为_______;其系统命名法的名称为______。
Ⅲ、现有CH4、C2H2、C3H4、C3H8 四种气态烃,回答下列问题(填分子式):
(1)当这四种气态烃质量相同时,分别在氧气中完全燃烧,消耗O2的量最多的是_____;生成水的量最少的是_____。
(2)在120℃,101Kp时,取上述气态烃中的某一种烃1L和3L过量的氧气在密闭容器中完全燃烧,恢复到原来的状况,测得燃烧后气体的总体积仍是4L,则该烃是____________。
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(2)该电池放电时,正极附近溶液的PH(填增大、减小、不变)
(3)充电时该电池阳极的电极反应式
(4)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了 g M,则金属M的相对原子质量为(用含“
g M,则金属M的相对原子质量为(用含“ 、x”的表达式表示)。
、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是;将电解后的溶液加水稀释至1L,此时溶液的PH=。
W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3∶8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)写出X的氢化物的电子式Z单质的晶体类型是类型
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是。(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)已知A、B、C、D四种物质存在如下反应关系:A+B―→C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是__________。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是__________________。
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为:
(4)甲同学最终确定原溶液中所含阳离子是,阴离子是(写离子符号)。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2.。
(1) 在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是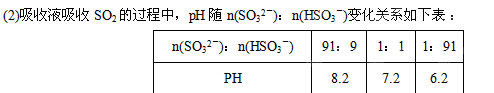
①由上表判断NaHSO3溶液显性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+) = 2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:,及用石膏降低其碱性的反应原理:。