下图表示一些晶体中的某些结构,它们分别是干冰、CsCl、NaCl、石墨、金刚石结构中的某一种的某一部分。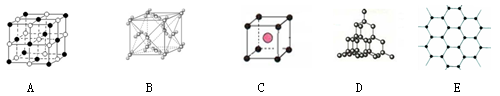
(1)代表石墨是 ;每一层内碳原子数与C—C化学键之比是 。
(2)上述B、C、D三种物质熔点由高到低的排列顺序为 。(用字母表示)
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,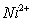 和
和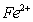 的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”)。
的离子半径分别为69pm和78pm,则熔点NiO FeO(填“<”或“>”)。
(4)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),X晶体中Al原子的配位数为 ,工业制备 X 的化学方程式为 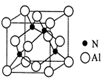
(10 分)已知:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空:
(1)amol NO完全转化为HNO3需要空气______mol;
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为_______(保留2位小数)。
(3)20.0moL的NH3用空气氧化,产生混合物的组成为:NO 18.0mol、O2 12.0mol、N2 150.0mol和一定量的硝酸,以及其它成分。(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率。
化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7
Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用,其理由是;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用;
(3)从晶体1→晶体2,该过程的名称是;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+ 的核外电子排布式是
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
| A.稳定性:甲>乙,沸点:甲>乙 | B.稳定性:甲>乙,沸点:甲<乙 |
| C.稳定性:甲<乙,沸点:甲<乙 | D.稳定性:甲<乙,沸点:甲>乙 |
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为。
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为。
(8分)有一瓶澄清溶液,可能含有 、
、 、
、 、
、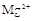 、
、 、
、 、、
、、 、
、 、
、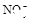 、
、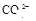 、
、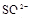 中的一种或几种。取该溶液进行以下实验:
中的一种或几种。取该溶液进行以下实验:
①用pH试纸检验,表明溶液呈强酸性;
②取出部分溶液,加入少量 及数滴新制氯水,经振荡
及数滴新制氯水,经振荡 层呈紫红色;
层呈紫红色;
③另取部分溶液,向其中逐滴加入NaOH溶液,使溶液从酸性变为碱性,在滴加过程中先生成白色沉淀后完全溶解;取部分碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝。
④另取部分③中的碱性溶液,向其中加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
根据以上实验事实回答下列问题:
(1)该溶液中肯定存在的离子是,肯定不存在的离子是;
(2)步骤③加入NaOH溶液过程中先生成白色沉淀后完全溶解的离子方程式为;
(8分)水蒸气通过的灼热的焦炭后,流出气体的主要成分是 CO 和 H2,还有 CO2和水蒸气等.现利用下图中提供实验装置,证明上述混合气体中有CO 和 H2.(A中加热装置在图中略去)回答下列问题:
(1)C装置的用途是
(2)仪器 E 中需加入的试剂是
(3)仪器 F 中需加入的试剂是:,其目的是
(4)能证明混合气中含有 CO 的实验现象是
(5)有人认为该实验装置存在一个缺陷,你认为这个缺陷是