元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_________(填元素名称)。
(2)根据元 素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaC l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
(4)由叠氮酸钠(NaN3)热分解可得光谱纯N2:2NaN3(s)===2Na(l)+3N2(g),下列有关说法正确的是 (选填序号)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.金属钠的晶胞结构如图所示,每个晶胞平均分摊2个钠原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
用化学用语完成以下各题:
(1)硫化氢在水中的电离方程式
(2)已知通常状况下,1.6g甲烷完全燃烧放出89.03kJ的热量,表示甲烷燃烧热的热化学方程式为
(3)通常状况,稀硫酸和氢氧化钠溶液发生中和反应的热化学方程式可表示为
(4)工业上采用合适的条件合成氨,其化学反应方程式为
(5)用CO可以合成甲醇。已知:
CH3OH(g)+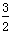 O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.6kJ·mol-1
CO(g)+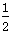 O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g)ΔH=-283.0 kJ·mol-1
H2(g)+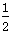 O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l)ΔH=-285.8 kJ·mol-1
则CO(g)与H2(g)合成 CH3OH(g)的 热化学方程式为
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g) 2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
2C(g) ΔH>0,反应达平衡后测得平衡常数为K,此时A的转化率为X。
(1)一段时间后上述反应达到平衡。则下列说法中不正确的是________(填字母)。
A.物质A、B的转化率之比为1∶1
B.起始时刻和达到平衡后容器中的压强之比为3∶(3-x)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=____________。
(3)该反应的逆反应速率与时间的关系
如图所示。
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时_________________________; t8时_________________________。
②t2时平衡向__________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g) 2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
2C(g) △H< 0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol。回答下列问题:
(1)0~10s内A的平均反应速率为 。
(2)反应达平衡时B在平衡混合气体中的体积分数为 。
(3)平衡后,其他条件不变的情况下,将体积压缩到原来的1/2时,对反应产生的影响是 。
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(4)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是 。
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.在隔热条件下,体系的温度不随时间而改变
(5)若在其他条件不变的情况下,采取下列措施反应达平衡C的百分含量不变的是 。
A.通入He气 B.使用催化剂
C.升高温度D.再充入1molA和1.5molB
(6)若保持原温度和容器容积不变再向其中充入2molA和1molB,平衡常数将 (填“增大” “减小”或“不变”),整个过程中物质B的转化率为 。
(1)下列ΔH表示物质燃烧热的是 ;表示中和热ΔH="-" 57.3 kJ·mol-1的是 。(填“ΔH1”、“ΔH2”和“ΔH3”等),ΔH1 ΔH3(填“>”、“<”或“=”)
| A.C(s)+1/2O2(g) = CO(g)ΔH1 |
| B.2H2(g)+O2(g) = 2H2O(l) ΔH2 |
| C.C(s)+O2(g)= CO2(g) ΔH3 |
D. Ba(OH)2(aq)+ Ba(OH)2(aq)+ H2SO4(aq)= H2SO4(aq)=  BaSO4(s)+H2O(l) ΔH4 BaSO4(s)+H2O(l) ΔH4 |
E.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)ΔH5
F.2NaOH(aq)+H2SO4(aq)= Na2SO4(aq)+2H2O(l) ΔH6
(2)在25℃、101kPa下,0.2mol液态甲醇燃烧生成CO2气体和液态水时放热144.0kJ。则表示甲醇燃烧热的热化学方程式为 。
(3)用“>”、“<”或“=”填空:
①同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的热效应(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
②相同条件下,2 mol氢原子所具有的能量________1 mol 氢分子所具有的能量。
③等质量的硫蒸汽、硫磺、分别在足量空气中燃烧所对应的热效应分别为ΔH1 、ΔH2 则ΔH1________ΔH2。
25 ℃,101 k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①(g)+2B(g) 2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
2C(g)+2D(l) ΔH1=-250.kJ·mol-1 K1=0.2
②(s)+B(g) C(g) ΔH2=-310 kJ·mol-1 K2=2
C(g) ΔH2=-310 kJ·mol-1 K2=2
③(g)+ B(g)
B(g) D(l) ΔH3=-200 kJ·mol-1 K3=0.8
D(l) ΔH3=-200 kJ·mol-1 K3=0.8
(1)则反应2E(s)+2F(g)+B(g) A(g)的ΔH= ,K= 。
A(g)的ΔH= ,K= 。
(2)写出反应①的平衡常数表达式: 。
(3)反应②的逆反应的平衡常数K4= 。
(4)对反应①而言,升高温度平衡常数 ,增大压强平衡常数 。(填“增大或降低或不变”)