将等物质的量的A,B混合于2L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
xC(g)+2D(g) ΔH<0经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,C(A):C(B)=1:2,C的平均反应速率为0.05mol/(L·min)
(l)x的值为_______________;
(2)A的平衡浓度____________;
(3)若恒温恒容,则容器中平衡时的压强与起始时的压强比___________;
(4)下图是某一时间段中该反应速率与反应进程的曲线关系图,回答下列问题:
①处于平衡状态的时间段是____________。
② 、
、 、
、 时刻体系中分别是什么条件发生了变化?
时刻体系中分别是什么条件发生了变化? ___________、
___________、 _____________ 、
_____________ 、 _____________(填A-E)
_____________(填A-E)
A.升温 B.降温 C.加催化剂 D.加压 E.减压
③下列各时间段时,A的体积分数最高的是____
A. B.
B. C.
C. D.
D.
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是,
又已知:H2O(液)=H2O(气);△H =+44kJ/mol,则11.2升(标准状况下)乙硼烷完全燃烧时生成气态水时放出的热量为。
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如下图所示,分析判断:________段化学反应速率最快。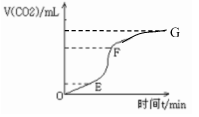
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是()
| A.蒸馏水 | B.氯化钠固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)
U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;U元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
①原子晶体②离子晶体③分子晶体④金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V、W的氢化物沸点最高的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明___________________________________________。
(6分)A、B、C、D、E、F、G均为短周期元素,它们在周期表中的位置如图所示。
请按要求回答下列问题。
| A |
|||||||
| D |
E |
||||||
| B |
C |
F |
G |
(1)A单质的收集方法为。
(2)上述元素形成的单质中,还原性最强的是(填写元素符号)。
(3)E元素是非金属性最强的元素,其阴离子的结构示意图是。
(4)F、G元素的最高价氧化物对应水化物的酸性强弱顺序是(填化学式)。
(5)B元素的最高价氧化物对应水化物与C元素的最高价氧化物对应水化物相互间反应的化学方程式是。
将下列物质进行分类:
①10B与11B ②O2和O3 ③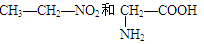
④C60和金刚石 ⑤冰和水 ⑥CH3—CH2—OH和CH3—O—CH3 ⑦ 1H+ 和2H—
(1)互为同位素的是_________(2)互为同素异形体的是____________
(3)互为同分异构体的是___________(4)属于同一化合物的是____________