下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: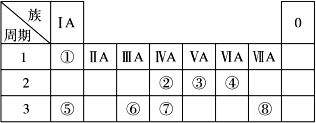
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。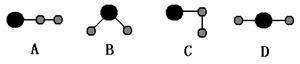
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: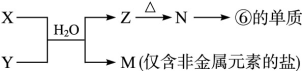
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知: △H=+67.7k
△H=+67.7k J·mol-1
J·mol-1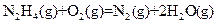 △H=-543kJ·mol-1
△H=-543kJ·mol-1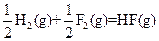 △H=-269kJ·mol-1
△H=-269kJ·mol-1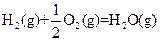 △H=-242kJ·mol-1
△H=-242kJ·mol-1
(1)肼和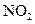 反应的热化学方程式为:。
反应的热化学方程式为:。
(2)有人认为若用氟气代替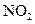 作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:。
作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式为:。
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是,反应的离子方程式为。
(3)实验室溶解该熔融物,下列试剂中最适宜的试剂是
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
中学常见的某反应的化学方程式为A+B―→C+D+H2O(未配平,反应条件略去)。请回答下列有关问题:
(1)若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则A与B反应的离子方程式为________________。
(2)若C、D均为气体,且都能使澄清石灰水变浑浊,则上述反应的化学方程式为__________________。
(3)若该反应是实验室制取C气体的反应。已知C是无色刺激性气味的气体,其水溶液呈弱碱性,C能发生催化氧化反应。写出该反应的化学方程式________________。
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2
⑴该反应中的还原剂是。
⑵该反应中,发生还原反应的过程是→。
⑶写出该反应的化学方程式,并标出电子转移的方向和数目。
⑷如反应转移了0.3mol电子,则产生的气体在标准状况下体积为。
(9分)取1.43g Na2CO3·XH2O 溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mL CO2(标况)。
求(1)稀盐酸物质的量浓度(2)Na2CO3·XH2O 的摩尔质量(3)x值_________