白磷与氧可发生如下反应:P4+5O2= P4O10。已知断裂下列化学键需要吸收的能量分别为: P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( )
H,其中正确的是( )
| A.(6a+5d-4c-12b) kJ·mol-1 | B.(4c+12b-6a-5d) kJ·mol-1 |
| C.(4c+12b-4a-5d) kJ·mol-1 | D.(4a+5d-4c-12b) kJ·mol-1 |
有关工业合成氨的反应:N2+ 3H2 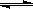 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( )
| A.该反应为可逆反应,故在一定条件下N2和H2不可能全部转化为NH3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产NH3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
氢氧燃料电池是一种新能源。如图为氢氧燃料电池示意图。下列说法不正确的是( )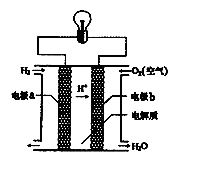
| A.a极是正极,b极是负极 |
| B.该装置能将化学能转化为电能 |
| C.电子由a极通过导线流向b极 |
| D.供电时总反应为2H2+O2=2H2O |
反应CO+H2O(g) CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是()
CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是()
| A.增大水蒸气的浓度 | B.将压强减小至原来的一半 |
| C.添加催化剂 | D.将反应温度升高至1200 K |
在下列说法中正确的是()
| A.1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
B.已知C(s)+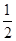 O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol O2(g)==CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.1mol H2SO4与lmol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.同温同压下,已知两个放热反应:2A(l)+B(l)="2C(g)" △H1; |
2A(g)+B(g)=2C(1) △H2,则△Hl>△H2
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )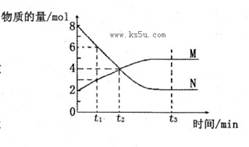
A.反应的化学方程式为:2 M N N |
| B.t1时,N的物质的量浓度是M物质的量浓度的2倍 |
| C.t2时,正逆反应速率相等,达到平衡 |
| D.t3时,正反应速率大于逆反应速率 |