(一).对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出, 为将槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。 (填编号)
a.NH3 b.CO2 c.NaOH d.HNO3
(2)以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,
阳极电极反应式为 。取少量废电解液,加入NaHCO3溶液,写出发生反应的离子方程式
(二).A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 |
元素性质或原子结构 |
| A |
单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B |
单质为生活中常见的金属,其相对原子质量比A大8 |
| C |
地壳中含量最多的金属元素 |
| D |
元素的主族序数是其所在周期序数的3倍 |
| E |
E的某种原子的原子核内没有中子 |
(1)在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
(2)A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,
ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,
则下列说法正确的是(已知氧化性Fe3+>I2) (填字母)。
a.A3+不与I-发生反应
b.A3+与F-结合生成不与I-反应的物质
c.F-使I-的氧化性减弱
d.A3+被F-还原为A2+,使溶液中不再存在A3+
有机物A1和A2分别和浓H2SO4在一定温度下共热都生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下:([O]表示氧化反应)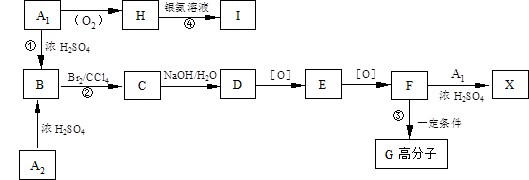
(1)反应①属于反应,反应②属于反应
(2)写出A2和X两种物质的结构简式:
A2X
(3)书写化学方程式:
③
④
(4)化合物E有多种同分异构体,请写出其中属于酯类且具有两个对位侧链的同分异构体的结构简式:
某芳香族化合物H(C11H12O4)是有机合成工业的一种重要的中间产物,其合成路线如下。已知2molC分子可缩合生成1mol六元环化合物分子。F常温下是气体,水溶液具有很好的防腐杀菌效果,且能与新制氢氧化铜反应。请回答下列问题: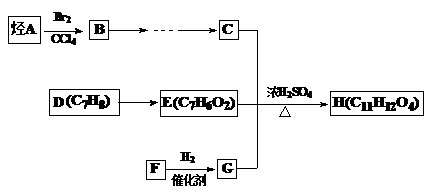
(1)F的电子式为, A的结构简式
(2)B转化为C的条件是
| A.水解、酸化、氧化、还原 | B.氧化、水解、酸化、还原 |
| C.水解、酸化、还原、氧化 | D.氧化、酸化、水解、还原 |
(3)以C为原料可合成可降解塑料,试写出其化学方程式
(4)H与氢氧化钠溶液反应的化学方程式
(5)H的同分异构体有多种,请写出符合下列条件的同分异构体的结构简式。(写一种即可)
①苯环上只有两个取代基,苯环上的一氯取代物只有两种
②1mol的H与足量的NaHCO3溶液反应,生成2molCO2
如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质缓缓地压到甲针筒内,进行下表所列的不同实验(气体体积在常温常压下测定)。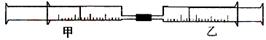
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
| 1 |
40 mL HCl |
40 mLNH3 |
产生白烟 |
| 2 |
40 mL Cl2 |
10mL 水 |
剩余气体为20mL |
| 3 |
30 mL NO |
15 mL O2 |
|
| 4 |
20 mL AlCl3溶液 |
10 mL NaOH溶液 |
生成白色沉淀,后消失 |
(1)如果实验1甲针筒内改装30 mL Cl2 ,乙针筒内仍为40 mLNH3,实验时,甲针筒内也有白烟产生。写出有关反应的化学方程式 。
(2)由实验2可知,常温常压下氯气在水中的溶解度为 。
(3)实验3 反应后甲针筒内气体的体积为 。
(4)实验4中,AlCl3溶液浓度为0.1mol/L,如果最后白色沉淀全部消失,则NaOH溶液浓度至少为 mol/L。
(5)将上述装置做以下改进:在甲、乙针筒之间连接一段硬质玻璃管,如下图。在A处装一种浅黄色的粉末,乙针筒内是一种常见的气体,甲针筒无气体。将乙针筒内气体压入甲针筒内,发现气体体积是原来的一半。A处的物质是 ,甲针筒内的气体为 。
(6)有学生用上述改进后的装置测定空气中氧气的体积分数(加热用酒精灯未画出)。乙针筒内装有50 mL空气。实验时,用酒精灯对A处物质进行加热,经反复慢慢推拉两针筒的活塞,反应完毕,恢复至室温,测得剩余气体为40.5mL。
①A处的物质是 (选填编号)。
a.碳粉 b.二氧化锰 c.铜粉 d.氧化铜
②已知空气中氧气的体积分数为0.2,则该实验的相对误差为 。
下表是四种盐在不同温度下的溶解度(g/100g水):
| NaNO3 |
KNO3 |
NaCl |
KCl |
|
| 10℃ |
80.5 |
21.2 |
35.7 |
31.0 |
| 100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
某同学设计用物质的量之比为1∶1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如下图所示:
(1)在①和②的实验过程中,需要控制的关键的实验条件是______________________,在上述晶体中,______(填“A”或“C”)应为硝酸钾晶体。
(2)在①的实验过程中,需要进行的操作依次是________________、________________、_____________。
(3)粗产品中可能含有杂质离子_______________________,检验其中一种离子的方法是________________________________________________________________________。
(4)为了洗涤所得的硝酸钾晶体,下列溶剂可用作洗涤剂的是___________(填编号)。
a.热水 b.冰水 c.95%的酒精 d.四氯化碳
(5)如取34.0g硝酸钠和29.8g氯化钾,加入70g水,在100℃蒸发掉50g水,维持该温度,过滤,析出晶体的质量为_______________。
工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)+2H2(g)  CH3OH(g)+Q
CH3OH(g)+Q
(1)能判断反应达到平衡状态的依据是(填字母序号,下同)________。
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的平均相对分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断该反应Q________(填“>”、“=”或“<”)0;
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2 mol/L,则CO的转化率为________,此时的温度为________。
(3)要提高CO的转化率,可以采取的措施是________。
a.升温;b.加入催化剂;c.增加CO的浓度;d.加入H2加压;e.加入惰性气体加压;f.分离出甲醇
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由:___________________________________________________。