瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4 + 4O2- - 8e- ="==" CO2 + 2H2O |
| D.当固体电解质中有1 molO2- 通过时,电子转移4 mol |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH-====2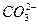 +6H2O,则下列有关说法不正确的是( )
+6H2O,则下列有关说法不正确的是( )
| A.放电时化学能转变为电能 |
| B.放电时CH3OH参与正极反应 |
| C.充电时阴极产生CH3OH |
| D.充电时每生成1 mol CH3OH,则转移6 mol电子 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是:Cu+2H+====Cu2++H2↑,则下列关于该装置的有关说法正确的是( )
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属铜为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
取pH=4的某电解质溶液1.00 L,用Pt电极进行电解,经过一段时间后,测得溶液的pH=1,且阴、阳两极产物的物质的量之比为2∶1,则该电解质溶液是( )
| A.盐酸 | B.氯化钾溶液 | C.硝酸银溶液 | D.硫酸铜溶液 |
按图4-36左装置进行实验,若右图的x轴表示流入电极的电子量,则y轴不可能表示的情况是( )
图4-36
| A.c(Ag+) | B.c( ) ) |
C.溶液的pH | D.银棒质量 |
下列叙述正确的是( )
| A.铜锌原电池工作时,正极从外电路得到电子 |
| B.用电解法精炼粗铜时,粗铜作阴极 |
| C.用惰性电极电解100 mL饱和食盐水,生成标准状况下112 mL H2时,电解液的pH约为13 |
| D.用铂电极电解NaOH稀溶液,一段时间后,溶液中溶质的质量分数不变 |