某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:
乙同学同样基于假设③设计另一实验方案如下: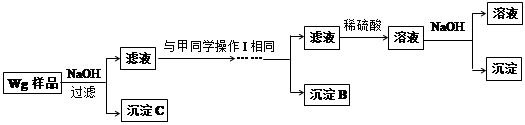
(1)Fe元素在周期表中的位置是第 周期 族。
(2)试剂M是 ;沉淀B是 。
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 。
(6)电解法制金属铝的化学方程式是 。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
下列有关实验的叙述,正确的是(填序号)
| A.用98%的浓硫酸配制100g10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶 |
| B.用渗析法分离淀粉中混有的NaNO3杂质 |
| C.无法用分液漏斗将乙二醇和水的混合液体分离 |
| D.用浓氨水洗涤做过银镜反应的试管 |
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅
拌
F.用酸式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液
G.用托盘天平称取10.50g干燥的NaCl固体
H.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀
刚好溶解为止
(10分)
为测定氯化钾和硫酸钾混合物中氯化钾的含量,某同学设计了如下实验:称量样品, 溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
溶解,添加适量A溶液,过滤,得沉淀和滤液B,将沉淀洗涤,烘干,得物质C。
回答下列问题:
(1)溶液A溶质的化学式_____,物质C的化学式____。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码质量为26g,游码为0.4g,则右盘样品实际质量是____。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是______。
(4)若C的质量为23.3g,则原混合物中氯化钾的质量分数为______。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: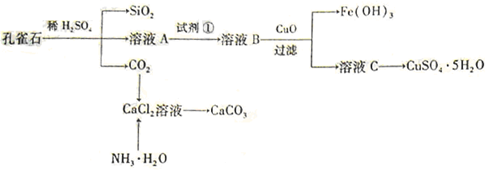
请回答下列问题:(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为 (填代号 ),检验溶液A中Fe3+的最佳试剂为 (填代号)。
),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4 b.(NH4) 2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)由框图可知制备CaCO3时,应向CaCl2溶液中先通入(或先加入) (填化学式)。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。
(4 )欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。)
)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时俯视容量瓶的刻度线,会使配制的浓度。(填“偏高”、“偏低”、“无影响”。)
某课外活动小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置。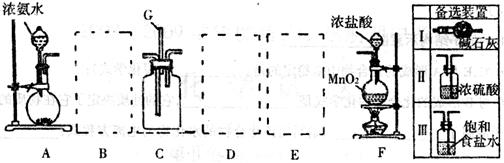
请回答下列问题:
(1)装置F中发生反应的离子方程式______________________________。
(2)装置A中烧瓶内固体可以选用__________(选填以下选项的代号)。
A.碱石灰 B.生石灰C.二氧化硅 D.氯化钙
(3)上图A—F是按正确实验装置顺序排列的。虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
B__________,D__________,E__________。
(4)C装置的反应原理可应用在检查输送氯气的管道是否漏气,写出检查输送氯气的管道是否漏气的化学方程式_______________________。请设计一个实验方案检验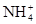 :
:
________________________________________________________________________。
(5)若从装置C的G处逸出的尾气中含有少量Cl2,写出尾气处理的离子方程式:
_____________________________________________________________。
I. 下列实验操作或对实验事实的描述不正确的是(填序号)
①分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③石油的分馏实验中,需将温度计的水银球插入液面以下以控制液体温度
④用瓷坩埚熔化各种钠的化合物
⑤测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照
⑥向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑦可用饱和碳酸氢钠溶液除去二氧化碳中混有的少量二氧化硫
II. (6分)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题: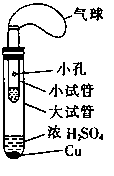
(1)写出制取SO2的化学方程式:。
(2)该反应中浓H2SO4表现的化学性质有。
(3)该同学利用实验现象来检验SO2的还原性,则选用的试剂为。
A.双氧水(H2O2) B.品红溶液 C.酸性高锰酸钾溶液
检验SO2还原性的试管中的现象为。