白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
有一工业废水,其中含有少量Fe2+、Ag+、Na+和SO42—。试设计一个实验方案,回收Ag并获得FeSO4·7H2O。请填写下表。
称为“塑料王”的是,制取它的方程式为,该反应的反应类型为。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+ |
<0.004 5 mol·L-1 |
| 细菌总数 |
<100个/mL |
以下是源水处理成自来水的工艺流程示意图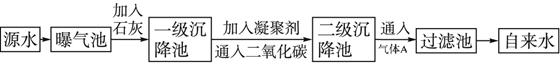
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式:_________________________。
(2)凝聚剂除去悬浮固体颗粒的过程____________(填序号)。FeSO4·7H2O是常用的凝聚剂,它在水中最终生成____________沉淀。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
(3)通入二氧化碳的目的是________________和______________________。
(4)气体A的作用是_________________________。这种作用是基于气体A和水反应的产物具有__________性。
(5)下列物质中____________可以作为气体A的代用品。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
Ⅰ.如图所示,在大试管里放入一段光亮无锈的弯成螺旋状
的铁丝,把试管倒插入水中,把这个装置这样放置约一周后,观察
到铁丝发生的变化是______________________,原因是
____________________.试管里的水面会上升,最终上升高度约为
________,原因是_________________________________________
________________________________________________________________________.
Ⅱ.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.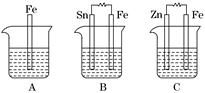
(1)A中反应的离子方程式为__________________________________________.
(2)B中Sn电极的电极反应式为________________________________________,
Sn电极附近溶液的pH__________(填“增大”、“减小”或“不变”).
(3)C中被腐蚀的金属是________,总反应式为________________________.比较
A、B、C中铁被腐蚀的速率,由快到慢的顺序是______________________.
将W g木炭与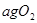 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为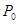 ,高温下容器中木炭与
,高温下容器中木炭与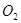 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为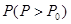 ,试求:
,试求:
(1)当W取值发生变化时,反应后压强P也发生变化,P的最大值(以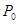 表示)是______。
表示)是______。
(2)以W表示满足题设条件的a的取值范围__________。
(3)在题设条件下,W、a、P、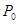 之间必须满足函数系W=f(a、
之间必须满足函数系W=f(a、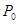 、P),写出该函数表达式:__________________。
、P),写出该函数表达式:__________________。