氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是 ;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是 ,其物质的量之比是 ;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为 。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
咖啡酸,存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等。咖啡酸有止血作用,特别对内脏的止血效果较好。
(1)咖啡酸的化学式是,咖啡酸中含氧官能团的名称为。
(2)咖啡酸发生加聚反应的化学方程式。
(3)下列关于咖啡酸的说法正确的是()
| A.1mol咖啡酸只与1mol溴反应 |
| B.咖啡酸有一种同分异构体的苯环上连4个羟基 |
| C.咖啡酸的水溶液中滴加氯化铁溶液显血红色 |
| D.可以用高锰酸钾或溴水检验咖啡酸分子中所含的碳碳双键 |
(4)写出1分子咖啡酸与2分子CH3COCl在一定条件下发生反应生成酯的方程式。
(5)A是咖啡酸的一种同分异构体,A中苯环上的取代基仅1个,1molA能与2molNaHCO3反应,A的结构简式为。
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如下: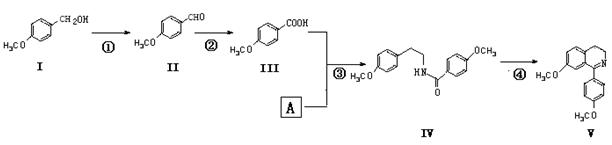
(1)化合物Ⅱ的化学式为,所含官能团的名称为____________________。
(2)反应①的化学方程式为(不要求写出反应条件)。
(3)化合物A的结构简式为。
(4)下列说法正确的是__________。
| A.化合物Ⅱ能与4 molH2发生加成反应 |
| B.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气 |
| C.化合物Ⅰ~Ⅴ均属于芳香烃 |
| D.化合物Ⅱ能发生银镜反应 |
(5)化合物VI与化合物Ⅲ互为同分异构体,VI中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的VI的结构简式:。
(6)化合物Ⅶ(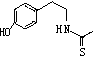 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
有机物A由碳、氢两种元素组成。现取0.2molA与一定量的氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应没有剩余)。将反应生成的气体依次通过浓硫酸、碱石灰和灼热的氧化铜,浓硫酸增重18g,碱石灰增重26.4g,氧化铜质量减少3.2g。
(1)通过计算确定该有机物的分子式;
(2)写出符合上述条件的有机物的结构简式。
下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种棕红色固体。
回答下列问题:
⑴C的化学式为;J的化学式为。
⑵写出由A生成H的离子反应方程式:。
⑶写出图中由F转化为G反应的离子方程式:。
下图为氢氧燃料电池的示意图:
⑴若以稀硫酸为电解液,则a极为____极。
⑵若以KOH溶液作电解液,则b极上的电极反应式为_______________________,放电一段时间后电解液的pH将________(填“变大”、“变小”或“不变”)。