甲、乙、丙、丁四种物质中,甲、乙、丙均含有某种相同的元素,它们之间具有如下转化关系(反应条件和部分产物已略去):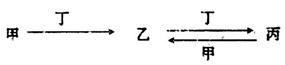
(1)若甲为常见金属单质,甲和丁的稀溶液反应生成无色气体,该气体遇空气变为红棕色。
①检验丙溶液中金属阳离子的试剂为________(填试剂名称)。
②向含n mol丁的稀溶液中加入m mol单质甲,二者恰好完全反应(假设还原产物只有上述无色气体),则n:m可能为__________(填代号)。
a.3:2 b.4:1 c.5:1 d.3:1
③常温下,丁的浓溶液可存放于甲制作的容器中,其原因是________________。
(2)若甲为氯碱工业的产品,含丙的某种药品可用于治疗胃酸过多。
①鉴别等浓度的乙溶液和丙溶液,可选用的试剂为________(填代号)
a.NaOH溶液 b.CaC12溶液 c.稀硫酸 d.澄清石灰水
②将甲、乙、丙三种溶液混合,向混合液中逐滴加入一定浓度的盐酸,生成气体的体积(标准状况)与加入盐酸的体积关系如下图所示: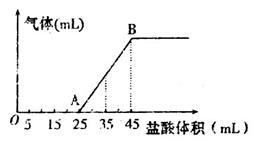
写出OA段所发生反应的离子方程式__________________________,当加入35mL盐酸时,产生气体的体积为22.4mL(标准状况),则盐酸的物质的量浓度为_______。
已知反应:
①SO2+2NaOH=Na2SO3+H2O
②SO2+2H2S=3S↓+2H2O
③SO2+Br2+H2O=H2SO4+2HBr
(1)将③反应中的反应物和生成物化学式填入下表。(每个格子只填一种)
| 类型 |
酸性氧化物 |
电解质 |
非电解质 |
| 化学式 |
(2)从①反应后的溶液中获取Na2SO3晶体,需进行的操作是;
从②反应后的溶液中获取S单质,需进行的操作是;
从③反应中提取剩余的Br2,需进行的操作是。
请在下列化学方程式上标出该反应中电子转移的方向和数目,并指出氧化剂、还原剂。
8NH3+3Cl2 ===6NH4Cl+N2氧化剂是_________,还原剂是_________。
按要求回答下列各题:
(1)某原子质子数为16,写出该原子的结构示意图;
(2)某一价阳离子的核外电子排布与Ne相同,写出该离子的结构示意图;
(3)核内中子数为N的R2+,质量数为A,则该离子的核外电子数为。
按要求完成下列各题:
(1)写出下列物质在水溶液中的电离方程式
H2SO4;MgCl2;NaHCO3;
(2)现代工业上用电解饱和食盐水的方法制取Cl2,反应的化学方程式为____________________
从一个关系量的单位,我们可以得出该量的计算公式,如:从摩尔质量的单位:g·mol-1,可得出分子应当是质量、分母应当是物质的量,因此摩尔质量的计算公式为 M = m / n,以此类推,物质的量浓度单位是,其计算公式c = ;
由微粒个数与物质的量的关系推出阿佛加德罗常数的公式NA= ;
气体摩尔体积的单位是,其计算公式是Vm= 。