按要求回答下列各题:
(1)某原子质子数为16,写出该原子的结构示意图 ;
(2)某一价阳离子的核外电子排布与Ne相同,写出该离子的结构示意图 ;
(3)核内中子数为N的R2+,质量数为A,则该离子的核外电子数为 。
有A、B、C、D四种短周期元素,其原子序数依次增大。A、B可形成A2B和A 2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
2B2两种化合物,B、C同主族且可形成CB2和CB3两种化合物。回答下列问题。
(1) A2B2的电子式为____________。
(2)CB2通入A2B2溶液中可被氧化为W,用W的溶液(体积为1 L,假设变化前后溶液体积变化忽略不计)组装成原电池(如图所示)。
在b电极上发生的反应可表示为:PbO2+4H++SO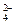 +2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
+2e-=PbSO4+2H2O,则在a电极上发生的反应可表示为_________________。
(3)金属元素E是中学化学常见元 素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反
素,位于元素周期表的第四周期。该元素可与D形成ED2和ED3两种化合物。将E的单质浸入ED3溶液中(如下图甲所示),溶液由黄色逐渐变为浅绿色,该反 应的离子方程式为____________________________________。
应的离子方程式为____________________________________。
(4)依据(3)中的反应,可用单质E和石墨为电极设计一个原电池,则在该原电池工作时,石墨一极发生的反应可以表示为______________________________。比较甲、乙两图,说明石墨除形成闭合回路外所起的作用是___________________________________。
(12分)A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1) )画出D元素的原子结构示意图____ ________。
________。
(2)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式,下同)、阳离子是____________、阴离子是。
(3) B的最高价氧化物对应的水化物中含有化学键的类型是____________。
(4) D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为__________________________________________。
现有如下两个反应:(A)NaOH+HCl=NaCl+H2O (B)2FeCl3+Cu=2FeCl2 +CuCl2
(1)根据两反应本质,判断能否设计成原电池___________________________________
(2)如果不能,说明其原因__________________________________________ _________
_________
(3)如果可以,请写出正负极材料名称和电极反应式。
________是正极,正极反应式:______________________
________是负极,负极反应式:______________________
合成氨和制备硝酸是两种重要的化工生产,四川某化工厂将合成氨与制备硝酸进行连续生产。其工艺流程见右图:
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质 的浓度(mol·L-1)
的浓度(mol·L-1)
如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是,若用CH4与过量水蒸气反应来制氢气,再与氮气合成氨,则理论上CH4与NH3的物质的量之比是。
(2)今对合成氨反应进行如下研究:
在容积均为10 L的a、b、c三个相同密闭容器
L的a、b、c三个相同密闭容器 中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是。
中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如右图所示。则下列说法正确的是。
| A.a、b、c三容器5 min时的正反应速率大小为:b>a>c |
| B.达到平衡时,a、b、c三容器中N2转化率为a>b>c |
| C.5 min时,a、b、c三容器中的反应均可能达到平衡状态。 |
| D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压 |
(3)工业上常用尿素作为氮氧化物的吸收剂对尾气进行处理。此法运行费用低,吸收效果好,吸收率高,不产生二次污染。其主要的反应为氮氧化物混合气与水反应生成亚硝酸(HN02),亚硝酸再与尿素[CO(NH2)2]反应生成CO2和N2。 ①HNO2的电子式_________________________
①HNO2的电子式_________________________
②亚硝酸与尿素[CO (NH2)2]反应的化学方程式为_____________________
(4)已知:N2(g)+O2(g)==2NO(g);△H= +180.5kJ/mol
4NH(g)+5O2(g)=4NO(g)+6H2O(g);△H="-905" kJ/mol
2H2(g)+O2(g) =2H2O(g);△H=—483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_mol·L-1。
存在于茶叶中的芳香族化合物A,其氧元素的质量分数为29.27%,苯环上的一氯代物有两种。1mol A分别与足量昀NaHCO3溶液和NaOH溶液反应,消耗的两种物质的量之比 为1:2。
为1:2。
(1)写出下列物质的结构筒式:CD
(2)A中含氧官能团的名称是,H—I的反应类型
B物质不能发生的反应类型有(填选项)
①取代反应②加成反应③消去反应④氧化反应⑤还原反应⑥水解反应
(3)写出下列反应的化学方程式:
A→E:
F→G:
(4)写出满足下列条件的A的所有同分异构体
①苯环上的一取代酯,②除苯环外不再含有其他的环状结构,
③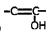 结构不稳定,容易转化为
结构不稳定,容易转化为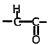
④能与金属Na反应写出满足上述条件的任意一种同分异构体与NaOH溶液反应的化学方程式