氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 |
断开1mol化学键所需的能量(kJ) |
| H—H |
436 |
| O—H |
463 |
| O=O |
498 |
①H2O的电子式是 。
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
|
| a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol·L-1 FeCl3溶液 |
| b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| c |
50 mL 5% H2O2溶液 |
少量浓NaOH溶液 |
1 mL 0.1 mol·L-1 FeCl3溶液 |
| d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。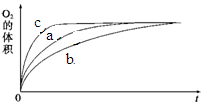
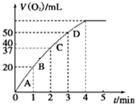
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
某二元酸(化学式用H2A)表示,在水中的电离方程式是:
H2A = H+ + HA-, HA- H++ A2-回答下列问题:
H++ A2-回答下列问题:
(1)Na2A溶液呈(填”酸性,中性或碱性”),理由是,用离子方程式表示:
.
(2)若0.1 mol•L-1NaHA溶液的pH = 2,则0.1 mol•L-1H2A溶液中氢离子的物质的量浓度可能是___________0.11 mol•L-1(填>、<、=)。理由是_________________________
(3)0.1 mol•L-1NaHA溶液中各种离子浓度由大到小的顺序是______________________
t℃时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:
3A(g) + B(g)  xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C平均反应速率为.
(2)x=;平衡常数K=.
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母);A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新平衡,此时B的物质的量为
n(B)=mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为:。
写出NaHCO3在水溶液中所发生的电离与水解反应的离子方程式,
并写出溶液中的电荷守恒的表达式
溶液中的物料守恒(即原子守恒)的表达式
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)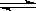 CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(选填吸热、放热)。
升高温度CO2的转化将(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: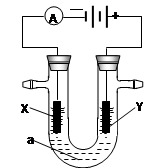
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应为。
在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。
检验该电极反应产物的方法是。