铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下: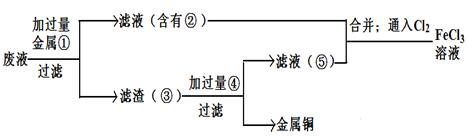
请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
下列微粒中:①Na+;② Fe3+ ;③ Cl-;④HCO3-;⑤ AlO2-
(1)既能电离又能水解的微粒是 (填序号)。
(2)②、③两种离子组成的盐的水溶液显 (填“酸性”或“碱性”或“中性”),用离子方程式表示原因 。
(3)④、⑤两种离子在水溶液中会发生反应而生成沉淀,写出相应的离子方程式 。
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0;
(2)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.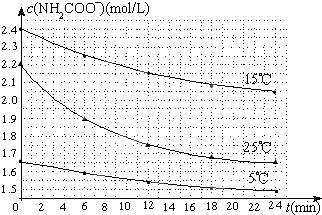
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
在一定条件下,可逆反应A+B mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
(1)温度T1 _____T2(填大于、等于或小于);
(2)正反应是__________反应(填“吸热”或“放热”);
(3)如果A、B、C均为气体,则m_____2(填大于、等于或小于);
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____(“增大”、“减小”或“不变”),平衡_______移动;当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡_______移动(填“向正反应方向”“向逆反应方向”或“不”)。
已知2A2(g)+B2(g) 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
研究NO2、SO2、CO等大气污染气体的处理具有重大意义。
(1)NO2可用水吸收,相应的化学反应方程式为_________________________;利用反应6NO2+8NH3═7N2+12H2O也可处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是____________L。
(2)已知:
2SO2(g)+O2(g)⇌2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)⇌2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的△H="_______" kJ•mol-1
(3)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______(填序号)
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=_______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应△H_____(填“>”或“<”),实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______。