在25℃和1.01×105Pa时,2N2O5(g)=4NO2(g) + O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )
| A.是吸热反应 | B.是放热反应 | C.是熵减反应 | D.是熵增效应大于能量效应 |
下列化学用语表示正确的是
A.CO2分子的比例模型示意图: |
B.三氟化氮的电子式: |
| C.二氧化硅的分子式:SiO2 | D.含有10个中子的氧原子: |
下面是有关厨房中的常见操作或者常见现象,其中不涉及氧化还原反应的是
| A.烧菜用过的铁锅,经放置常出现红棕色斑迹 | B.灶具大理石板被食醋腐蚀变得不光滑 |
| C.铜质炊具长久不用生铜绿 | D.用煤气灶燃烧天然气为炒菜提供热量 |
几种微粒具有相同的核电荷数,则可说明
| A.可能属于同一种元素 | B.一定是同一种元素 |
| C.彼此之间一定是同位素 | D.核外电子个数一定相等 |
2011年3月12日,日本福岛第一核电站由于地震原因而发生爆炸,造成放射性物质泄漏,核电站周围检测到铯137和碘131超标。核电站为阻止高辐射污水由碎石层流入竖井裂缝进入海中,向碎石层内注入“水玻璃”。几天后受“吃加碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知食盐中添加的碘盐为KIO3,下列说法正确的是
A.核素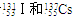 ,前者比后者少3个中子B."水玻璃”是硅酸钠的俗称,是一种黏合剂
,前者比后者少3个中子B."水玻璃”是硅酸钠的俗称,是一种黏合剂
C.KIO3中碘元素的化合价是+5 D 互为同位素
互为同位素
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
| 氧化物 |
环境问题 |
主要来源 |
|
| A |
CO2 |
酸雨 |
化石燃料的燃烧 |
| B |
SO2 |
光化学烟雾 |
汽车尾气的排放 |
| C |
NO2 |
温室效应 |
工厂废气的排放 |
| D |
CO |
CO中毒 |
燃料的不完全燃烧 |