有X、Y、Z、W四种元素,它们的单质X、Y、Z在常温常压下皆为气体,W为固体。
①X单质可在Z单质中燃烧生成XZ,其火焰为苍白色;W单质在Y单质中剧烈燃烧产生黄色火焰,生成W2Y2;
②每2molX2可与1molY2化合生成2molX2Y,X2Y在常温下为液体;
③化合物XZ的水溶液可使蓝色石蕊试纸变红;W与水反应后的溶液可使无色酚酞试液变红色;
④Z单质溶于化合物X2Y,所得溶液具有漂白作用;请回答:
(1)画出Z原子的原子结构示意图 ;实验室中的W应保存在____________中(填试剂名称)
(2)写出化学式W2Y2___________ _
(3)写出与W+具有相同核外电子数的分子或原子,请写出任意3种的化学式
① ② ③
(4)Z单质与水反应的离子方程式:_________________________
⑸W单质与X2Y化学反应方程式:__________________________
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称),以下三种说法中,可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象
乙:①用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
②再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH1(填“>”、“<”或“=”);
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4D.2 mol·L-1 HA
(3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积 V的关系如图所示,则下列说法不正确的有
V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为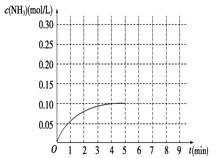
a.0.20 mol/L b.0.12 mol/Lc.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条 件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)
件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g)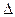 H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B
H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B 的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量②加压③升温④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
阅读下面两条科普信息,回答问题:①一个体重为50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形 式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
(1)这两则科普信息分别介绍了人体内和海水中亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有性,铁离子具有性。
(2)①中的维生素C是剂。②中的CO2是剂,CH2O是产物。
(3)已知含Fe3+的盐可用于净水,因为水解生成的氢氧化铁胶体具有吸附性,写出实验室制备氢氧化铁胶体的离子方程式