已知酸性条件下有反应:2Cu+=Cu2++Cu,由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体,一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
| 加入试剂 |
稀硫酸 |
浓硫酸.加热 |
稀硝酸 |
浓硝酸 |
| 实验现象 |
红色固体和蓝色溶液 |
无色气体 |
无色气体和蓝色溶液 |
红棕色气体和绿色溶液 |
由此推出本次氢气还原氧化铜实验的产物是
A.Cu B.一定有Cu,可能有Cu2O
C.Cu2O D.一定有Cu2O,可能有Cu
绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是
①太阳能 ②风能 ③石油 ④煤⑤潮汐能⑥木材
| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.①②⑤ |
下列反应中属于加成反应的是
| A.乙烯使酸性高锰酸钾溶液褪色 |
| B.将苯滴入溴水中,振荡后水层接近无色 |
| C.乙烯使溴水褪色 |
| D.甲烷与氯气混合,光照一段时间后黄绿色消失 |
关于可逆反应达到平衡状态的说法错误的是
| A.外界条件不能改变平衡状态 |
| B.达平衡时正、逆反应速率相等 |
| C.各组分的含量不随时间而变化 |
| D.是动态平衡 |
将铜丝灼烧变黑后立即放入下列物质中,铜丝变红,且质量不变的是
| A.硫酸 | B.乙醇 | C.二氧化碳 | D.硝酸 |
下列反应属于放热反应的是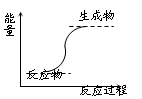
| A.氢氧化钡晶体和氯化铵晶体的反应 |
| B.能量变化如上图所示的反应 |
| C.化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
| D.燃烧反应和酸碱中和反应 |