铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。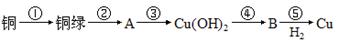
(1)从三种不同分类标准回答,“铜绿”属于哪类物质?___________________________。
(2)请写出②处的离子方程式。______________________________________________________________,
(3)上述转化过程中属于氧化还原反应的是_________(填序号,下同),属于复分解反应的是__________。
A、B、C、D是四种短周期主族元素,其中B的原子序数最小,A、B同主族,C、D同主族,A比C的核外少两个电子;D元素一种原子的质量数是其质子数的两倍多2,又是该原子最外层电子数的3倍。判断A、B、C、D各是什么元素,并比较A、B、C三种元素的最高价氧化物对应的水化物溶液酸、碱性的相对强弱。
(1)A_____、B_____、C_____、D_____。(填元素符号)
(2) _____ (填酸性或碱性):_____>_____>_____。(填分子式)
A、B、C为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。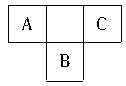
(1)写出A、B、C三元素的名称:A是_____,B是_____,C是_____。
(2)B、C两元素可形成BC6型化合物,该化合物(填“能”或“不能”)燃烧,其理由是:__________。
假定元素周期表是有限的,请根据已知的元素周期表的某些事实和理论填写出可归纳出的一些假说。
(1)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在_____周期,_____族(注:把零族看成ⅧA)。周期表示在填满_____周期后将结束)。
(2)根据周期表中每个周期非金属元素的种数(把稀有气体元素看作非金属),预测周期表中应该有_____种非金属元素,还有_____种未发现。未发现的非金属处在_____周期_____族。
A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。如果A和B同在ⅠA族,当B在A的上周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____;如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为_____;当B在A的下一周期时,B的原子序数为_____。若A的氯化物化学式为ACly,分子中各原子最外层电子数之和为26,则y的值为_____。
A、B、C、D、E、F的原子序数依次增大,它们都具有相同的核外电子层数。已知:A、C、F三种原子最外层共有11个电子,且这三种元素原子的最高价氧化物对应水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素的符号:A ,B ,E 。
(2)把B的单质(片状)放入滴有酚酞的沸水中,观察到的现象是 ,反应的化学方程式是 。
(3)A、C两种元素的最高价氧化物对应水化物反应的离子方程式是 。