在一密闭容器中进行如下反应:2SO2(气)+O2(气)  2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
| A.SO2为0.4mol/L、O2为0.2mol/L |
| B.SO2为0.25mol/L |
| C.SO2、SO3均为0.15mol/L |
| D.SO3为0.4mol/L |
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素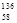 Ce、 Ce、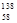 Ce、 Ce、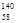 Ce、 Ce、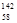 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。 |
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.原子半径的大小顺序为W>Q>Z>X>Y |
| B.元素X的气态氢化物与Q的单质可发生置换反应 |
| C.元素X与Y可以形成5种以上的化合物 |
| D.元素Q的最高价氧化物对应的水化物酸性比W的强 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3- |
| B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl- |
| C.FeCl3溶液:K+、Na+、I-、SO42- |
| D.由水电离产生的c(H+)=10-13mol·L-1的溶液:K+、Na+、Cl-、HCO3- |
下列叙述正确的是
| A.两原子如果核外电子排布相同,则一定属于同种元素 |
| B.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| C.ⅠA族与ⅦA族元素间只能形成离子化合物 |
| D.非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构 |
相同质量的钠在下列情况下产生氢气最多的是
| A.放在足量水中 |
| B.放在足量盐酸中 |
| C.放在足量CuSO4溶液中 |
| D.用刺有小孔的铝,包好放入足量水底中 |