已知氧化性:Au3+>Ag+>Cu2+>Pb2+>Cr3+>Zn2+>Ti2+。现有如图所示的电化学装置,下列叙述中正确的是
| A.若X为Ti,则Y极的电极反应式可能是Zn-2e-=Zn2+ |
| B.若X为Cr,则Y可以选Zn或Ti |
| C.若Y为Cu,则X极的电极反应式可能是Cr-3e-=Cr3+ |
| D.若Y为Pb,则Xn+(aq)中阴离子数会减少 |
在恒温恒容的容器中进行反应H2S(g) H2(g) + S(g),若反应物浓度由1mol/L降到0.6mol/L需20s,那么由0.6mol/L降到0.24mol/L,需反应的时间为()
H2(g) + S(g),若反应物浓度由1mol/L降到0.6mol/L需20s,那么由0.6mol/L降到0.24mol/L,需反应的时间为()
| A.等于18s | B.等于12s | C.大于18s | D.小于18s |
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()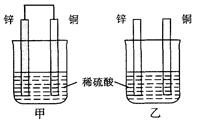
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.甲、乙溶液均变蓝 |
我国十分重视海水资源的综合利用,下列物质不需经化学变化就能从海水中获得的是()
A.氯 、溴、碘 、溴、碘 |
B.钠、镁、铝 | C.烧碱、氢气 | D.食盐、淡水 |
下列说法正确的是()
| A.酸碱中和反应是吸热反应 |
B.吸热反应不加热 就不会发生 就不会发生 |
| C.放热反应不用加热也一定能发生 |
| D.反应是放热还是吸热可以看反应物和生成物所具有的总能量的相对大小 |
有关化学用语正确的是()
| A.乙烯的最简式:C2H4 |
| B.乙醇的结构简式:C2H6O |
C.NaCl的电子式: |
D.乙酸 乙酯的分子式:C4H8O2 乙酯的分子式:C4H8O2 |