室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是()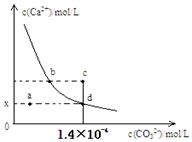
| A.x的数值为2×10-5 |
B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成a点 | |
| D.b点与d点对应的溶度积相等 |
二氧化硫催化氧化反应(接触法制硫酸):2SO2(g)+O2(g)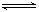 2SO3(g)
2SO3(g)
△H=-196kJ·mol-1有关叙述错误的是()
| A.一定温度下,增大压强,转化率增大,平衡常数不变 |
| B.2molSO2和1molO2反应放出热量小于196kJ |
| C.反应物键能之和小于生成物键能之和 |
| D.焓变△H和熵变△S都有利于反应正向进行 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为
KOH溶液,其充、放电按下式进行:
.. Cd + 2NiOOH + 2H2O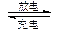 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
.. 有关该电池的说法正确的是()
| A.充电时阳极反应:Ni(OH)2-e— + OH- ="=" NiOOH + H2O |
| B.电池充电时,电池正极和电源的负极连接。 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)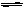 H2(g)+CO2(g)
H2(g)+CO2(g) H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是()
H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可采用的是()
| A.升温 | B.加催化剂 |
| C.再加入n molCO和n molH2O | D.再加入2n molCO2和2n molH2 |
某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度
为ρ g/cm3)。下列叙述错误的是()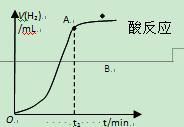
| A.t1时刻锌镀层已完全反应 |
| B.锌镀层的厚度为 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,负极的电极反应式为Zn- 2e → Zn2+ |