下列离子方程式正确的是
| A.铝与稀盐酸反应 Al+2H+=Al3++H2↑ |
| B.三氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| C.用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
| D.二氧化碳与石灰水反应 CO2+2OH-=CO32-+H2O |
将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是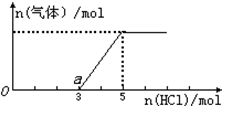
| A.O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| B.O到a点发生反应的离子方程式: H++OH-=H2O、CO32-+H+=HCO3- |
| C.通入CO2气体的体积在标准状况下为44.8L |
| D.NaOH溶液的物质的量浓度为5mol•L-1. |
在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为: “FeSO4 +KNO3 + H2SO4= K2SO4 +Fe2(SO4)3+NxOy+ H2O”,则对该反应的下列说法正确的是
| A.反应中还原产物是NO |
| B.氧化产物和还原产物的物质的量之比为1∶8 |
| C.反应过程中转移的电子数为4e- |
| D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5 |
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
| A.在含[Al(OH)4]-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、[Al(OH)4]-、SO32- |
| B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ |
| C.含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3 |
| D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+ |
下列离子方程式正确的是
| A.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+ |
| B.NH4HCO3溶于过量的NaOH溶液中:HCO3−+OH−=CO32−+H2O |
| C.小苏打溶液中加过量Ba(OH)2溶液:2HCO3−+Ba2++2OH−=BaCO3↓+2H2O+CO32− |
| D.澄清石灰水中通入过量二氧化碳:OH-+CO2 =HCO3- |
物质在反应中可表现氧化性、还原性、酸性、碱性等,下面方程式中划线的物质,能在同一反应中同时表现上述两种或两种以上性质的有
①3FeO + 10HNO3= 3Fe(NO3)3+ NO↑+ 5H2O
②C + 2H2SO4(浓) = CO2 ↑+ 2SO2 ↑+ 2H2O
③8NH3+ 3Cl2= 6NH4Cl + N2
④2Na2O2+ 2H2O =" 4NaOH" + O2↑
| A.①② | B.①④ | C.③④ | D.全部 |