部分难溶物的颜色和常温下的Ksp如下表所示:
| |
Cu(OH)2 |
CuOH |
CuCl |
Cu2O |
| 颜色 |
蓝色 |
黄色 |
白色 |
砖红色 |
| Ksp(25 ℃) |
1.6×10-19 |
1.0×10-14 |
1.2×10-6 |
— |
某研究性学习小组对电解食盐水进行了如下探究:
实验Ⅰ装置如图所示,接通电源后,发现a、b电极上均有气泡产生。
(1)电解过程中的总离子反应方程式为_________________________________________。
(2)为了确定电源的正、负极,下列操作一定行之有效的是 。
A.观察两极产生气体的颜色
B.往U形管两端分别滴入数滴酚酞试液
C.用燃着的木条靠近U形管口
D.在U形管口置一张湿润的淀粉KI试纸
实验Ⅱ把上述电解装置的石墨棒换成铜棒,用直流电源进行电解,装置如图所示。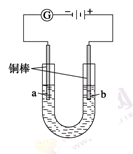
观察到的现象如下所示:
①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显砖红色。
(3) a极发生的电极反应方程式为________________________________________________________。
(4) 电解5 min后,b极发生的电极反应方程式为___________________________________________。
(5)12 min后,b极附近出现的橙黄色沉淀的成分是 ,原因是___________________________________________________________________________________。
按要求写出下列填空
(1)分子式为C5H12的烷烃一氯取代物只一种的结构为(结构简式);写主链含5个碳原子,分子中支链只有甲基、乙基2个支链的烷烃有(写结构简式,并用系统命名法命名)。
(2)甲基的电子式是;羟基的电子式。
(3)2,3-二甲基-2-丁烯的结构简式;
(4)CH3 CH(CH3) CH2CH (C2H5)CH3的名称为。
某待测液中可能含有Ag+、Fe3+、K+、Ba2+、NH4+等离子,进行如下实验:
(1)加入过量的稀盐酸,有白色沉淀生成。
(2)过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
(3)过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现。
(4)另取少量步骤(3)中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:待测液中一定含有离子,一定不含有离子,还有一种离子不能确定是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象,不要求写实验操作过程)
。
(10分)新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
(1)使新制氯水呈现浅黄绿色的物质是;
(2)能起杀菌消毒作用,光照易分解的弱酸是;
(3)能与硝酸银溶液作用生成白色沉淀的离子是。
(4)取少量新制氯水于试管中,加入FeCl2溶液,发现很快变黄,起作用的成分是Cl2,说明氯气具有性。写出该反应的离子方程式。
(8分)将一小块金属钠投入盛有水的烧杯里,钠“浮”在水面,说明。钠熔化成闪亮的小球,说明 。
向烧杯中滴加酚酞试液,溶液呈色,原因是。
两性氢氧化物是(写化学式)。
写出该物质与氢氧化钠溶液反应的化学反应方程式为