向50mL稀硫酸和稀盐酸的混合溶液中,加入3.42g氢氧化钡粉末,充分反应后过滤,得到干燥的沉淀物2.33g,所得溶液中氢氧根离子的浓度为0.1mol/L,试求原混合液中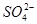 和
和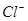 的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
的物质的量浓度(假定在混合液中加入氢氧化钡粉末后体积未改变)。
一定条件下,在密闭容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有10mol N2,求平衡后N2、H2、NH3的物质的量及N2的转化率。
(4分) 用氨氧化法制硝酸时,如果氨的利用率是80%,则用3.4吨氨制得45%硝酸多少吨?
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)  CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
CO2(g)+H2(g),已知CO(g)和H2O(g)的起始浓度均为2mol·L-1,经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡,若未达到平衡,向哪个方向进行?
(2)达到平衡时,CO的转化率为多少?
(3)当CO的起始浓度仍为2mol·L-1,H2O(g)的起始浓度为6mol·L-1,求平衡时CO的转化率?
(1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH=;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH=。