乙酸乙酯是常见酯类化合物,其实验室制备提纯过程如下:
制备反应:CH3COOH+CH3CH2OH  CH3COOC2H5+H20
CH3COOC2H5+H20
实验步骤:
①按照下图制备装置组装一起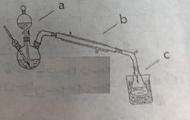
②在三颈瓶中加入4mL乙醇,慢慢振荡加入5mL浓硫酸。仪器a内装预先混合均匀的10mL乙醇和8mL乙酸
③先从a中放出3mL混合液,于石棉网上加热110-120℃.有馏分分出时,打开a活塞,控制流速(每分钟30滴)。至滴加完毕无馏分时停止加热。
④摇动盛粗产品的锥形瓶,向其中加入饱和碳酸钠溶液至有机相呈中性。
⑤将液体转入分液漏斗中,摇振后静置,弃水相。有机相依次用饱和食盐水洗涤后和饱和氯化钙溶液洗涤,每次均弃水相。
⑥有机相转入干燥的锥形瓶,加无水硫酸镁干燥。
试回答:
1、仪器a、b的名称分别为______ 、______。
2、实验步骤②加入过量的乙醇的目的是 。还需要加入______。
3、实验步骤5中摇荡静置后如图所示,请写出弃水相的操作 。
4、试写出实验过程中发生的副反应的方程式:乙醇被浓硫酸脱水碳化同时放出SO2: 。
5、步骤③中滴加速度过快会使乙酸乙酯的产率降低,造成产率降低的原因可能是:
①
②
(12分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵: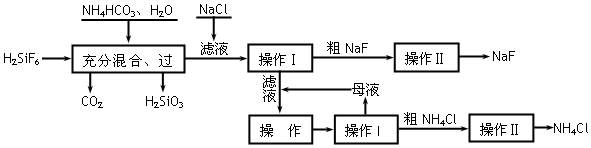
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3 g、20℃时37.2 g、30℃时41.4g;氟化钠:20℃时4 g;氟硅酸钠微溶于水。
请回答下列问题:
⑴上述流程中发生两步化学反应,第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
⑵操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
⑶操作II的作用是 。
⑷操作Ⅲ的具体过程是 。
⑸流程中NH4HCO3必须过量,其原因是 。
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是___________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引
起Na2CO3含量的测量结果比实际值偏低,理由是____________________。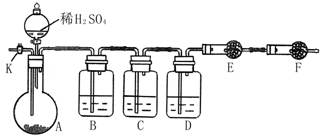
(4)实验室中备有以下常用试剂:
a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷 i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是______________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为____。
为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。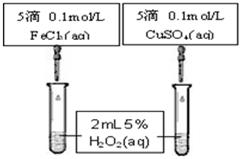
①可通过观察来定性比较得出结论。
②有同学提出将CuSO4改为CuCl2更为合理,其理由是,你认为还可以作何改进?。
试回答下列问题:
(1)下列实验中所选用的仪器或操作以及结论不合理的是____。
| A.用托盘天平称量11.7g氯化钠晶体 |
| B.加热NH4Cl晶体时,用湿润红色石蕊试纸靠近试管口,检验NH3的生成 |
| C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠 |
| D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上与标准比色卡比较 |
E.仅用蒸馏水和pH试纸,就可以鉴别pH相等的H2SO4和CH3COOH溶液
F.用锌和稀硫酸制H2时,为了使制取H2的速率加快,可以向稀硫酸溶液中加入少量CuSO4溶液
G.用碱式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液;
H.不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
I.用瓷坩埚高温熔融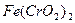 和
和 固体混合物;
固体混合物;
J.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备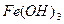 胶体;
胶体;
K.配制 饱和溶液时,加入少量的稀硫酸.
饱和溶液时,加入少量的稀硫酸.
(2)欲量取20.00mL Na2CO3溶液,应选用的仪器是。
(3)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、、。
(4)在硫酸铜晶体中结晶水含量的测定实验中,称量操作至少要进行次。
某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
⑴打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是。
⑵打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是;仪器D在该装置中的作用是。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是。