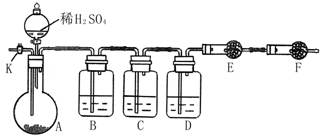
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)
(1)将仪器连接好以后,必须进行的第一步操作是___________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引
起Na2CO3含量的测量结果比实际值偏低,理由是____________________。
(4)实验室中备有以下常用试剂:
a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷 i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是______________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为____。
实验室欲用NaOH固体配制1.0 mol/L的NaOH溶液240 mL;
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为_________。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示。烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________。
| A.转移溶液时不慎有少量洒到容量瓶外面 |
| B.定容时俯视刻度线 |
| C.未冷却到室温就将溶液转移到容量瓶并定容 |
| D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 |
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: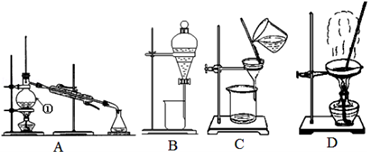
(1)从氯化钠溶液中得到氯化钠固体,选择装置 (填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 ;从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(2)装置A中①的名称是 ,冷却水的方向是______________,温度计水银球的位置是在 ;装置B在分液时装置中的液体不能顺利滴下,原因是______________________。
(3)从碘水中得到碘时,不能选用的试剂是____________
A.酒精 B.苯 C.四氯化碳
若选则试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后,下层液体的颜色为 。
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| 实验操作 |
实验现象 |
|
| I |
打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c |
B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色。 |
| II |
用注射器取出少量B装置中的溶液,加入KSCN溶液 |
溶液变为红色。 |
| III |
打开活塞b,向A装置中加入足量硫酸,关闭活塞b |
A中产生气体;B中有气泡,液面上有少量红棕色气体生成。 |
| IV |
一段时间后,用注射器取出少量B装置中的溶液,…… |
…… |
| V |
打开活塞a,通入一段时间空气 |
———— |
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)________。
(2)实验I中,发生反应的离子方程式是________。
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+: Fe2+ + NO [Fe(NO)]2+
[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是________________________。
(4)分析实验现象,同学们得出了结论。则:
① 实验IV的后续操作是________________,观察到的现象是________________。
② 由实验得出的结论是_______________________。
(5)实验反思
① 实验操作V的目的是_______________________________________。
② 实验操作III,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是________。
③ 有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气。你是否同意该看法,理由是________________________________________。
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
| 成分 |
Cl- |
Na+ |
SO42- |
Mg2+ |
Ca2+ |
HCO3- |
Br- |
| 含量/(mg·L-1) |
18980 |
10560 |
2560 |
1272 |
400 |
142 |
64 |
(1)以食盐为原料进行生产并综合利用的某些过程如下图所示。
①除去粗盐中的Ca2+、Mg2+和SO 离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
离子,加入沉淀剂a.Na2CO3 b.NaOH c.BaCl2,
合理的一种顺序是(填序号) 。将滤液的pH调至酸性除去的离子是 。
②电解饱和食盐水的化学方程式是 ;
③侯德榜向饱和食盐水中通入NH3、CO2气体制NaHCO3晶体的化学方程式为 。
其依据是 。
④工业上可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2制取有效成分为NaClO的消毒液,反应的化学方程式是 。(碳酸的酸性强于次氯酸)。
(2)利用海水可以提取溴和镁,提取过程如下:
① 从MgCl2溶液中得到MgCl2·6H2O晶体的主要实验操作是 、洗涤、烘干。从MgCl2·6H2O晶体中得到无水MgCl2的主要方法是
②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_____________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________。
③依据上述流程,若将5 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。
碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: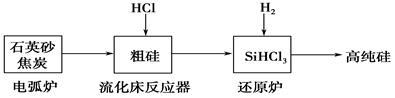
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2 355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。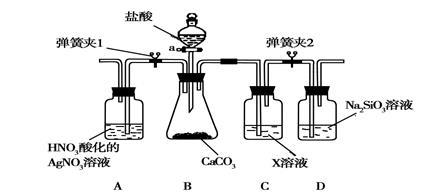
① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。