决定物质性质的重要因素是物质结构。请回答下列问题。
(1)下图是石墨的结构,其晶体中存在的作用力有 (填序号) 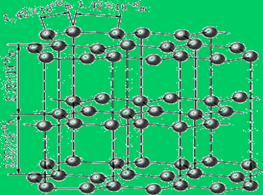
A:σ键 B:π键 C:氢键 D:配位键 E:分子间作用力 F:金属键 G:离子键
(2) 下面关于晶体的说法不正确的是___________
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
(3)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)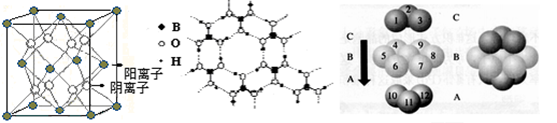
图Ⅰ 图Ⅱ 图Ⅲ
① 图I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,
图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;
② H3BO3晶体中B原子杂化方式______ ; CNO-的形状为____________;
③ 三种晶体中熔点高低的顺序为 (填空化学式),
H3BO3晶体受热熔化时,克服的微粒之间的相互作用为
(4) 碳的某种单质的晶胞如右图所示,一个晶胞中有_____个碳原子;若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶体中最近的两个碳原子之间的距离为_ ____cm(用代数式表示)
有机物A的结构简式为:
据此回答下列问题:
(1)A的分子式为____________________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为________________________________。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式:
。
二乙酸-1,4-环己二醇酯可通过下列路线合成:
(1)①的反应类型________, ②的反应类型________,
⑤的反应类型________, ⑦的反应类型________。
(2)试写出由 的所有反应的化学方程式:
的所有反应的化学方程式:
⑤______________________________________________________________,
⑥ ,
⑦ ,
⑧ 。
下列物质:①O2 ②三氯甲烷 ③CH3CH2CH2OH ④O3 ⑤CHCl3 ⑥CH3OCH2CH3
⑦C ⑧CH3CH(OH)CH3 ⑨C ⑩CH3OH。其中属于同系物的有________(填序号,下同),互为同分异构体的有________,互为同素异形体的有________,属于同位素的有________,是同一种物质的有________。
丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下: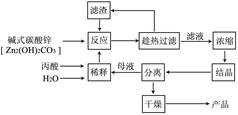
| 序号 |
n(丙酸)∶n(碱式碳锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2h,用水量45g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
(2)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为 。
(3)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: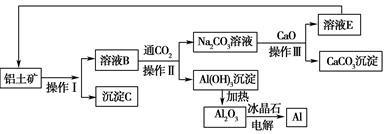
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________。
(2)写出由溶液B生成Al(OH)3的离子方程式:__________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为_____________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。