已知:2M(g) N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
N(g);△H <0。现将M和N的混和气体通入体积为1L的恒温密闭容器
中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
| A.a、b、c、d四个点中处于平衡状态的点是a、b |
| B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D.若40min后出现如图所示变化,则可能是加入了某种催化剂 |
下列操作正确的是
| A.给试管内的液体加热,可使试管口对准自己,不能使试管口对准别人 |
| B.用KMnO4制取O2时,先检验装置的气密性,然后再加药品 |
| C.把NaOH固体直接放在天平的左盘上称量 |
| D.稀释浓H2SO4时,可向盛浓H2SO4的量筒中小心加水 |
为除去粗盐溶液中的 Ca2+、Mg2+、SO42-及泥砂,可进行下列五项操作,其中不正确的操作顺序是
①过滤 ②加过量的 NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液
| A.⑤④②①③ | B.④①②⑤③ |
| C.②⑤④①③ | D.⑤②④①③ |
将标准状况下的 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
A.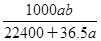 mo1·L-1 mo1·L-1 |
B.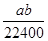 mol·L-1 mol·L-1 |
C.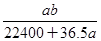 mol·L-1 mol·L-1 |
D.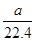 mol·L-1 mol·L-1 |
实现下列变化,一定要加入其它物质作氧化剂的是
| A.CaCO3 → CO2 | B.NaCl → NaNO3 |
| C.CuO → CuSO4 | D.Zn → ZnCl2 |
设阿伏加德常数为NA。则下列说法正确的是
| A.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
| B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C.常温常压下,18g H2O中含有的电子数为3NA |
| D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+数为0.2NA |