已知某可逆反应在密闭容器中进行:A(g)+2B(g)  3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
3C(g)+D(s) △H<0,下图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )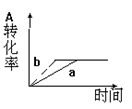
| A.增大A的浓度 | B.增大容器的体积 |
| C.加入催化剂 | D.升高温度 |
在给定的四种溶液中,加入以下各种离子,各离子一定能在原溶液中大量共存的有
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.c(H+)2=Kw的溶液:K+、Al3+、Cl—、HCO3— |
25℃时,0.1mol/L稀醋酸加水稀释,右图坐标中的纵坐标y可以是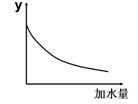
| A.溶液的pH |
| B.醋酸的电离平衡常数 |
| C.溶液的导电能力 |
| D.醋酸的电离程度 |
25℃时在五份蒸馏水 中分别加入适量的下列物质,所得实验结果如下表所示:
中分别加入适量的下列物质,所得实验结果如下表所示:
| 加入物质 |
HCl(aq) |
FeCl3 |
NaOH |
HCOONa |
C2H5OH |
| 溶液的pH |
3 |
4 |
10 |
11 |
未测定 |
| 水的电离程度 |
α1 |
α2 |
α3 |
α4 |
α5 |
加入物质后水的电离程度由大到小排列顺序正确的是
A.α3>α1>α5>α4>α2 B.α4>α2>α5>α3>α1
C.α2>α4>α5>α1>α3 D.α1>α3>α5>α2>α4
下列溶液蒸干后,能得到溶质固体的是
| A.AlCl3 | B.KHCO3 | C.Fe2(SO4)3 | D.NaClO |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是
A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42—
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱