工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A.反应(1)和(2)均为氧化还原反应 |
| B.反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3 |
| C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D.反应(1)中每生成1molNa2CrO4时电子转移3mol |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图1装置),下列有关说法正确的是()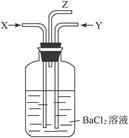
图1
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
铜和浓硝酸反应产生的气体,用排水法收集到a L气体(标准状况),被还原的硝酸是()
| A.a/22.4 mol |
| B.a/11.2 mol |
| C.3a/22.4 mol |
| D.3amol |
两份质量均为a g的硫,在一定条件下分别跟足量的氢气和氧气完全反应,反应后将生成物混合,析出硫的质量为()
| A.2a g | B.a g | C.1.5a g | D.0.5a g |
酸雨形成的主要原因是()
| A.汽车排放的大量尾气 |
| B.生产硫酸工厂排放的尾气 |
| C.工业上大量含硫燃料的燃烧 |
| D.乱砍滥伐,破坏了生态平衡 |
在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是()
| A.溶液的导电性与溶液中离子的浓度有关 |
| B.溶液的导电性与溶液中离子数目的多少有关 |
| C.灯泡最暗时溶液中无自由移动的离子 |
| D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |