下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+ O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是()
| A.35Cl原子所含质子数为18 |
B.1/18 mol的1H35Cl分子所含中子数约为 |
| C.3.5g的35Cl2气体的体积为2.24L |
| D.35Cl2气体的摩尔质量为70 g/mol |
下列说法正确的是()
| A. | 晶体中只存在离子键 |
| B. | 含 、 的水都是硬水 |
| C. | 雾是气溶胶,在阳光下可观察到丁达尔效应 |
| D. | 玻璃是氧化物,成分可表示为 |
下列叙述正确的是()
| A. |
聚丙烯的结构简式为: |
| B. |
石英的化学式为: |
| C. |
原子的结构示意图为: |
| D. |
在 中各原子最外层均能达到8电子的稳定结构 |
下列表示溶液中发生反应的化学方程式错误的是 ()
()
| A. | ↑ |
| B. | ↑ |
| C. |
 ↑
↑
|
| D. |
下列化学用语使用不正确的是
| A. |
的结构示意图  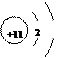  |
| B. | 纯碱的化学式为 |
| C. | 聚乙烯的结构简式为 |
| D. | 高氯酸(
)中氯元素的化合价为+7  |