用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,22.4LCCl4含有NA个分子 |
| B.常温常压下46gNO2和N2O4混合气体含有3NA个原子 |
| C.0.1molAlCl3完全转化为氢氧化铝胶体,生成0.l NA个胶体粒子 |
| D.0.1molCl2与足量NaOH溶液反应,转移电子数为0.2 NA |
向足量H2SO4溶液中加入100mL 0.4mol·L﹣1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol·L﹣1盐酸时,放出的热量为2.2 kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣2.92 kJ·mol﹣1 |
| B.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣18 kJ·mol﹣1 |
| C.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣73 kJ·mol﹣1 |
| D.Ba2+(aq)+SO42﹣(aq)═BaSO4(s) △H=﹣0.72 kJ·mol﹣1 |
化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,下列叙述中正确的是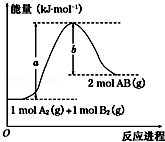
| A.每生成2个分子AB吸收(a﹣b) kJ热量 |
| B.该反应热△H=+(a﹣b)kJ·mol﹣1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量 |
对于达到平衡的反应:2A(g)+B(g)⇌nC(g),符合如图所示的结论是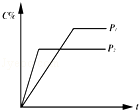
| A.P1>P2,n>3 | B.P1>P2,n<3 | C.P1<P2,n>3 | D.P1<P2,n<3 |
利用反应:2NO(g)+2CO(g)⇌2C02(g)+N2(g)△H=﹣746.8kJ•mol﹣1,可净化汽车尾气,如果要同时提高反应的速率和N0的转化率,采取的措施是
| A.降低温度 |
| B.增大压强 |
| C.升高温度同时充入N2 |
| D.及时将C02和N2从反应体系中移走 |
在一密闭烧瓶中,在25℃时存在着平衡:2NO2⇌N2O4(正反应放热).把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色;②平均分子量;③质量;④压强;⑤密度
| A.①和③ | B.②和④ | C.④和⑤ | D.③和⑤ |