设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
可逆反应2SO2(g)+O2(g) 2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是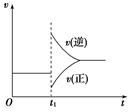
| A.维持温度、反应体系体积不变,t1时充入SO3(g) |
| B.维持压强不变,t1时升高反应体系温度 |
| C.维持温度不变,t1时扩大反应体系体积 |
| D.维持温度、压强不变,t1时充入SO3(g) |
某温度下,在一容积可变的容器里,反应2A(g) B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol、4 mol。在保持温度和压强不变的条件下,下列说法正确的是
A.将A、B、C各物质的量都减半,C的百分含量不变
B.充入A、B、C各1 mol,平衡将向正反应方向移动
C.充入1 mol 稀有气体氦(He),平衡不移动
D.加入一定量的A气体达平衡后,C的百分含量一定增加
氢离子浓度都为1×10—2mol/L的盐酸和醋酸各100 mL分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,有关叙述正确的是
| A.醋酸与锌反应放出氢气多 |
| B.盐酸和醋酸分别与锌反应放出的氢气一样多 |
| C.刚开始反应时,醋酸与锌反应速率小 |
| D.盐酸和醋酸分别与锌反应的平均速率一样大 |
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,(已知pH=-lgc(H+))下列叙述错误的是:
| A.该溶液的pH="4" |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
| t/s |
0 |
500 |
1000 |
1500 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3