用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
(4)若平衡时H2和HCl的物质的量之比为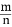 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 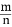 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(8分)在25 ℃时,有pH为x的盐酸和pH为y的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液。问:
(1)若x+y=14,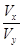 =___________(填数值);
=___________(填数值);
(2)若x+y=13,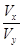 =__________(填数值);
=__________(填数值);
(3)若x+y>14,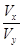 =____________________________________(表达式),
=____________________________________(表达式),
且Vx________Vy(填“>”、“<”或“=”)(题中x≤6,y≥8)。
(6分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式),非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______________(写出其中两种物质的化学式)。
(4)ZX的电子式为 。
(1)分别取1mol葡萄糖进行下列实验:
①若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为_____________L,反应的化学方程式为_____________________________________________________。
②与乙酸反应生成酯,从理论上讲完全酯化需要______g乙酸。
(2)将蔗糖溶于水,配成10%的溶液,分装在两个试管中,在第一支试管中加入新制Cu(OH)2悬浊液后加热没有变化,原因是蔗糖分子中___________;在第二支试管中加入几滴稀H2SO4,再在水浴中加热,加NaOH中和酸后也加入新制Cu(OH)2悬浊液后加热,现象是_________________,原因是____________。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
| X |
Y |
|
| Z |
W |
请回答下列问题:
(1)元素Z位于周期表中第_______周期,_______族;
(2)这些元素的氢化物中,水溶液碱性最强的是_____________(写化学式);
(3)XW2的电子式为________________________;
(4)Y的最高价氧化物的化学式为_________________。
21.(12分)已知A是气态烃,完全燃烧时产生的CO2和H2O的物质的量之比为1∶1,气体A相对于H2的密度为21,在下图变化中,中间产物F跟葡萄糖一样也能跟新制的Cu(OH)2发生反应产生红色沉淀,H有香味,I为高分子化合物。
已知:
(1)写出下列各步变化的化学方程式(注明反应条件)
反应②_________________________________________________________;
反应⑤_________________________________________________________;
反应⑧_________________________________________________________。
(2)写出下列反应类型:
反应①_____________________,反应②_____________________,
反应⑤_____________________,反应⑧_____________________。