用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
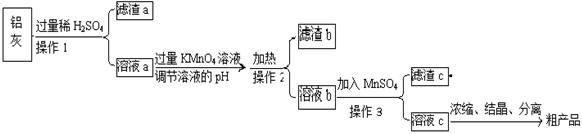
(1)滤渣a可用于制造
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:

若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
(16分) 下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。

(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
(18分) 根据以下有机物之间的转化关系框图,回答问题:
(1)已知:B、C的分子结构中均带有支链,B的结构简式为__________,C在浓硫酸加热条件下只能得到一种结构的烯烃D,C的结构简式可能为___________或___________,D的高名称为(用系统命名法命名)_________________。
(2)F中含有的官能团的名称为____________________。
(3)③和⑥的反应类型分别是_____________、___________。
(4)H能与H2在催化剂加热条件下1:1反应生成K,写出满足下列条件的K的所有同分异构体的结构简式:a.能发生银镜反应,b.属于酯类
___________________________________________.
(5)分别写出反应④⑦⑧和⑨的化学方程式:
④_____________________________________________________;
⑦_____________________________________________________;
⑧_____________________________________________________;
⑨_____________________________________________________。
(12分) Ⅰ.某离子晶体特征结构如图A所示。X●位于立方体部分顶点,Y○位于立方体中心。试分析: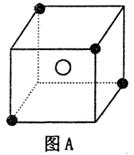
(1)每个Y同时吸引着_______个X,该晶体的化学式为______________。
(2)晶体中每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX是___________。
(4)设该晶体的摩尔质量为M g/mol,晶体密度为 g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为__________cm。
g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的X中心间距为__________cm。
Ⅱ.B4Cl4是一种淡黄色并具有挥发性的固体化合物,在70℃以下,它存在于真空中。结构测定表明:该化合物中每个氯原子均结合一个硼原子,其键长都是0.170nm,任意两个硼原子之间为0.171 nm。每个硼原子周围各有4个共价键。根据上述性质和参数画出B4Cl4分子空间构型的示意图______________________。
(14分) 某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应的离子方程式为_________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的离子方程式为__________________。
(3)若A为第二周期的单质,B为第二周期某元素最高价氧化物的水化物,C、D均为气体,则该反应的化学方程式为______________________________________________。
(4)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,则A是______或_______,B为_____________(填化学式,下同)。
(5)若C、D均是能使澄清石灰水变浑浊的气体,则A与B的组合为_____________。
取3.40g只含羟基、不含其他官能团的液态饱和多元醇,置于5.00 L氧气中,经点燃,醇完全燃烧。反应后气体体积减少0.56 L。将气体经CaO吸收,体积又减少2.80 L(所有体积均在标准状况下测定)。
(1)3.40g醇中C、H、O物质的量分别为:Cmol、Hmol、Omol;该醇中C、H、O的原子数之比为。
(2)由以上比值(填“能”或“不能”)确定该醇的分子式,其原因是。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式。