Ⅰ、物质的分离和提纯有多种方法。物质分离、提纯方案的设计在科学研究和工业生产中占有十分重要的地位。工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等,已知SiO2是不溶于水的酸性氧化物,Fe2O3是不溶于水的碱性氧化物)。某研究小组设计的提纯Al2O3的方案如下:
(1)写出沉淀A的化学式:___________________________________________________。
(2)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________________________。
(3)写出由沉淀A—→Al2O3的化学方程式:________________________,通入过量CO2生成沉淀A时反应的离子方程式为_______________________________________________。
Ⅱ、按照要求回答下列问题:
A、B、C、D、E是常见化合物或单质,有如下转化关系 (略去条件和副产品)。
(1)若A为黄绿色气体单质,D、E为生活中常见的两种金属,其中E是一种红色光亮的物质。
① 写出向B的溶液中加入足量D的离子反应方程式_____________________________________。
②向①所得的溶液中加入NaOH溶液,并在空气中放置的现象是:_________________________,写出固体在空气中放置的化学反应方程式:__________________________________________。
浓硫酸在实验室可用来干燥Cl2、HCl等气体,这是利用了浓硫酸的__________性。 蔗糖遇浓硫酸变黑,是由于浓硫酸具有__________性。若将盛有浓硫酸的容器敞口放在空气中一段时间后, 其质量会__________(填“增加”、“减少”或“没有变化”)。
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。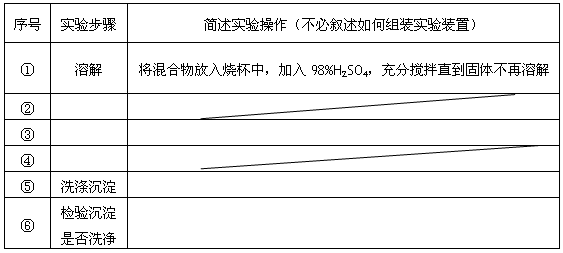
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(O2)/mol |
0.7 |
0.4 |
0.3 |
x |
x |
x |
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0~1s内该反应的平均反应速率为;
(2)O2的平衡浓度c(O2)=;
(3)4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是____________(用百分数表示)。
(5)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀____________克(计算结果保留一位小数)。
有A、B、C、D、E、F、G、H、I九种常见物质,它们的转化关系(反应条件未注明)如图所示。常温下A为液态,D为固态,B、C、E、G为气态(C可以使带火星木条复燃),其中B、C、D为单质,F为淡黄色粉末状化合物,I的焰色反应为黄色。
请回答:(1)写出F的电子式。(2)G的结构式是。
(3)反应④是反应(填“吸热”或者“放热”)
(4)写出反应⑤的化学反应方程式
(5)B、C单质已被应用于字宙飞船的燃料电池中,如图所示。若将B换成甲烷也能组成燃料电池(两个电极均由多孔性碳构成),该电池工作时:
①b电极附近溶液的pH将(填“增大”“减小”“不变”);
②a电极上的电极反应式为:。
(6)在标准状况下,若将3.36L气体G通入50mL 4mol/L的H溶液中,用一个离子方程式表示其过程:
已知A、E是生活中常见的两种有机物;B是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平;A能在酸性高锰酸钾的条件下生成E; C是高分子化合物。在一定条件下由A可以转变为有机物B、C、D、E、F(A、B、D、E碳原子数相等)。转变关系如下: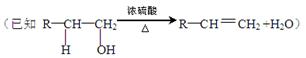
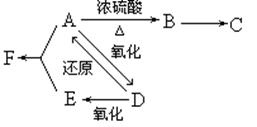
请回答下列问题:
(1)B的电子式是____________。
(2) E的官能团名称是____________。
(3) 写出实现下列转化的化学方程式
①A→D
② B→C
(4) A是一种高效、低耗、污染小的可再生的清洁能源,已知1molA完全燃烧生成CO2气体和水蒸气放出1367kJ热量,则在相同条件下,1molA完全燃烧生成CO2气体和液态水,放出的热量________1367kJ(填“>”、“=”或“<”)。
(5) 在可逆反应当中,产率指的是某种生成物的实际产量与理论产量的比值.若100克A和120克E反应生成了88克F,则F的产率是____________(用百分数表示)
(6)下列关于A、B、C、D、E、F六种物质说法正确的是____________
A.C具有固定的元素组成,因而有固定的熔沸点
B.C中有不饱和键,所以能使高锰酸钾溶液褪色
C. 取等物质的量的B和C完全燃烧后,生成的CO2和H2O的物质的量分别相等
D.由B生成C是通过加聚反应制得的
E. 分别燃烧1molA和B生成CO2和H2O的耗氧气量,其中A和B耗氧量相等
F.在 A+E→ F转变中,有含氧的小分子生成,小分子的氧原子来至于A