设NA为阿伏伽德罗常数的值。下列说法正确的是
| A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B.常温下,10LpH=13的NaOH溶液中含有的OH-离子数为NA |
| C.标准状况下,11.2L己烷中含有分子的数目为0.5NA |
| D.100mL0.1mol·L-1的FeCl3溶液中含有Fe3+的个数为0.01 NA |
将amol钠和amol铝一同放入mg水(足量)中,所得溶液的密度为dg/mL,该溶液的质量百分比浓度为( )
A.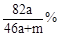 |
B.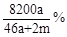 |
C.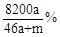 |
D.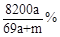 |
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法错误的是( )
| A.锡青铜的熔点比纯铜低 |
| B.在自然环境中,锡青铜中的锡对铜起保护作用 |
| C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 |
| D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程 |
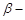 紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1
紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1
下列说法正确的是( )
A.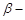 紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色 紫罗兰酮和中间体X都可使酸性KMnO4溶液褪色 |
B.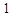 mol中间体X最多能与 mol中间体X最多能与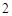 mol H2发生加成反应 mol H2发生加成反应 |
C.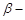 紫罗兰酮分子式为:C13H22O 紫罗兰酮分子式为:C13H22O |
D.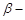 紫罗兰酮与中间体X互为同分异构体 紫罗兰酮与中间体X互为同分异构体 |
氮化钠和氢化钠与水反应的化学方程式如下:Na3N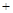 3H2O → 3NaOH + NH3↑,
3H2O → 3NaOH + NH3↑,
NaH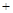 H2O → NaOH
H2O → NaOH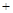 H2↑。有关Na3N和NaH的叙述正确的是( )
H2↑。有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na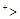 N N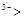 H H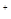 |
B.加热熔化时,都只破坏离子键 |
| C.与盐酸反应都只生成一种盐 | D.与水反应都是氧化还原反应 |
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)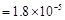 ,Ka(HSCN)
,Ka(HSCN)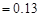 。在物质的量浓度均为
。在物质的量浓度均为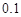 mol·L
mol·L 的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
的CH3COONa和NaSCN混合溶液中,下列排序正确的是( )
A.c(OH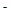 )>c(CH3COOH)>c(HSCN)>c(H )>c(CH3COOH)>c(HSCN)>c(H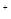 ) ) |
B.c(OH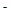 )>c(HSCN)>c(CH3COOH)>c(H )>c(HSCN)>c(CH3COOH)>c(H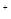 ) ) |
C.c(OH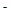 )>c(SCN )>c(SCN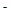 )>c(CH3COO )>c(CH3COO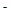 )>c(H )>c(H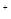 ) ) |
D.c(OH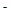 )>c(CH3COO )>c(CH3COO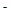 )>c(SCN )>c(SCN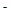 )>c(H )>c(H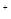 ) ) |