某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 |
现象 |
结论 |
离子方程式 |
| 第一步 |
取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 |
|
|
| 第二步 |
|
若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 |
|
探究二
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用: 。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由__________ __。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
已知二氧化硫可使高锰酸钾溶液褪色,反应的化学方程式为:5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4
用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2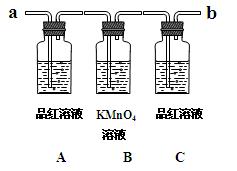
①实验时,反应产生的气体应从端通入;从端连接盛有澄清石灰水的实验装置(用 “a”或“b” 填空)。
②可观察到A瓶的溶液的现象。
③B瓶溶液的作用是。
④C瓶溶液的作用是。
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000mol·L -1的氢氧化钠溶液(指示剂为酚酞)滴定得结果如下:
| NaOH起始读数 |
NaOH终点读数 |
|
| 第一次 |
0.40mL |
18.50mL |
| 第二次 |
1.30mL |
18.05mL |
| 第三次 |
3.10mL |
21.20mL |
(1)达到滴定终点的时溶液颜色的变化为 色到色;
色到色;
(2)根据以上数据可以计算出盐酸的物质的量浓度为;
(3)以下操作造成测定结果偏高的原因可能是。
| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.未用标准液润洗碱式滴定管 |
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl—和Br—的还原性强弱。
①选择合理的装置连接:→→。(填字母编号)
②从下列提供的试剂选择你所需的试剂:。(填字母编号)
a. 固体氯化钠 b. 固体二氧化锰c. 浓硫酸
d. 浓盐酸 e. 稀盐酸 f.溴化钠溶液
③实验现象及结论:。
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验,其操作步骤为
①先关闭止水夹,再打开止水夹,使NO2充满试管乙。接着关闭止水夹,打开止水夹 ,最后微热试管乙,使烧杯中的水倒流进入试管乙。
,最后微热试管乙,使烧杯中的水倒流进入试管乙。
②试管乙中的NO2与 水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是(气体按标准状况计算)。
水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是(气体按标准状况计算)。
某同学设计了以下流程来检验碳酸钠粉末中含有少量氯化钠和氢氧化钠。
(1)步骤3的操作名称是;步骤1所需玻璃仪器是;
(2)试剂A是,加入试剂A 的目的是;(填字母编号)
a.检验OH- 离子 b. 检验Cl-离子
c.除去CO32-离子 d.避免对Cl-或OH-的检验的干扰
判断试剂A是否足量的方法是。
(3)步骤4是为了检验离子,所需要的试剂B是。
(4)请简述步骤5的具体操作过程(所加试剂、现象及结论)
孔雀石主 要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下:
要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下: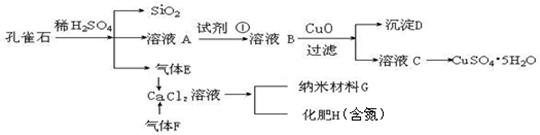
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 ,
加入CuO作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入) (填化学式)。
写出该反应的化学方程式 。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。