某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是_______________(填实验序号),步骤②中加热所用仪器的名称是___________________;
(2)步骤③中洗涤沉淀的操作是___________________________________。
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较
用下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:

| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2 g |
无其他物质 |
|
| ⑤ |
1.2 g |
CuO 0.5 g |
|
| ⑥ |
1.2 g |
MnO2 0.5 g |
|
回答下列问题:
(3)上述实验中的“待测数”据指_____________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是___________(填“酸式”或“碱式”)滴定管;
(5)若要读取实验⑤中干燥管内收集的气体体积,应注意 ____________________
____________________________________________________;
⑹为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a._______________________________,
b.CuO的化学性质有没有改变
下图是用干燥纯净的Cl2与Cu粉反应来制取无水氯化铜的装置图,请回答下列问题: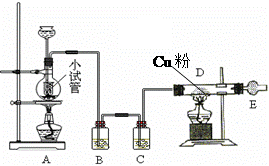
⑴ 小试管的作用是;烧瓶中发生反应的化学方程式是;
⑵ B瓶中的溶液是,其作用是;C瓶中盛放的溶液是,其作用是。
⑶ 玻璃管D中反应的现象是。
⑷ 干燥管E中盛有碱石灰,其作用是。
⑸ 开始实验时,应先点燃处(填“A”或“D” )的酒精灯,当时再点燃另一处的酒精灯。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为;漂白粉有效成分为(填名称);瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。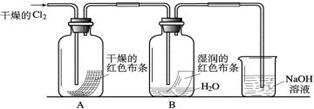
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是;其中发生的反应的化学方程式为。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是。
c.烧杯中溶液所起的作用是,烧杯中所发生反应的化学方程式为。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
mL。
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H 2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒。转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水注入容量瓶直到液面接近刻度处。改用滴加蒸馏水到瓶颈刻度的地方。振荡摇匀后,装瓶贴签。
(4)在配制过程中,其他操作都准确,下列操作中错误的是(填序号,以下同),能引起误差偏高的有。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)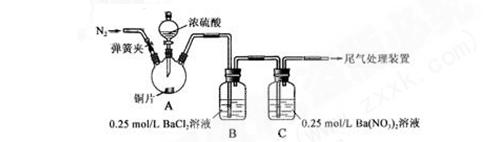
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚 未发现白色沉淀溶解 未发现白色沉淀溶解 |
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认 为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选
为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选 用▲ (选填序号)。
用▲ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为▲。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。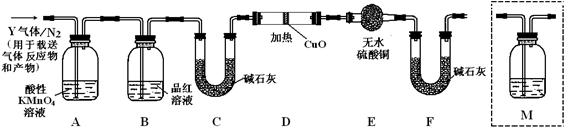
(3)装置B中试剂的作用是▲
(4)分析Y气体中的Q2气体是如何生成的▲(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于▲(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是▲