炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为 (填名称)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH
“滤渣2”的主要成分是 (填化学式,下同)。
(4)“试剂Y”是___________
(5)“操作1”是 ;在“操作1”时,必须采取的实验措施是 。
选考【化学——选修2:化学与技术】某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定)。
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
(1)滤渣a的成分是________,用乙醇洗涤废催化剂的目的是________,从废渣中回收乙醇的方法是________。
(2)为提高酸浸速率,可采取的措施有(答两条)________________。
(3)向A中加人 H2O2时反应的离子方程式为__________.试剂x可以是________。
(4)用方程式表示出由沉淀。制取单质镍的方法_________、________。回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为________kg(填计算式)。
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应。
与电镀相比,化掌镀的最大优点是:________________________________。
(14分)磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69 1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
(1)仪器E的者称是_______,由B的使用可知SO2与氧气之间的反应居于______(填“放”或“吸”)热反应,仪器C的作用是________________________.
(2)仪器组装完毕后,检验甲装置气密性的方法是____________表明装置气密性良好。
(3)试剂X、Y的组合最好是_________。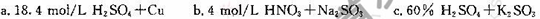
(4)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(5)反应结束后,将丙中混合物分离开的实验操作是_________。若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为_________(保留三位有效数字)。
某小组通过实验研究Na2O2与水的反应。
| 操作 |
现象 |
| 向盛有4gNa2O2的烧杯中加入50mL蒸馏水得到溶液a |
剧列反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴酚酞 |
ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂(填化学式),有气体产生。
Ⅱ.乙同学查资料获悉:用KMnO4可以测定H2O2含量: 取15.00mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol·L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00 mL KMnO4溶液。
①请配平:MnO4-+H2O2+H+ ="=" Mn2++O2↑+H2O
②溶液a中c(H2O2)=mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是。
(3)为探究现象ⅱ产生的原因,同学们继续实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色。
Ⅳ.向0.1mol·L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验Ⅲ和Ⅳ中,可得出的结论。
②同学们通过进一步实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中,。
工业废渣、废水回收利用是重要研究课题。下面流程是生产食用香料正丁酸乙酯的工厂废水(含乙醇、正丁酸乙酯、正丁酸、乙醚和大量无机悬浮物)联合利用电子工业废料(含SiO2和Cu2(OH)2CO3)回收铜的工艺设计。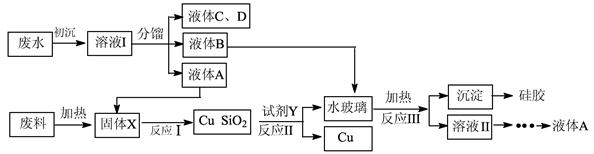
回答下列问题:
(1)初沉加入的试剂是明矾,写出参与净水的离子的水解方程式:。
(2)固体X的成分是,反应I的化学反应方程式。
(3)试剂Y为;加快反应II速率的措施有(任写一条)。
(4)反应Ⅲ的离子方程式为:。
(5)硅胶在生活与生产中用途广泛,写出其中一种用途。
B.【实验化学】
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下: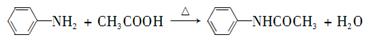
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
| 物质 |
熔点 |
沸点 |
溶解度(20 ℃) |
| 乙酰苯胺 |
114.3 ℃ |
305 ℃ |
0.46 |
| 苯胺 |
-6 ℃ |
184.4 |
3.4 |
| 醋酸 |
16.6 ℃ |
118 ℃ |
易溶 |
实验步骤如下:
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照下图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是____。
(2)步骤2中控制温度计示数约105 ℃的原因是____。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是____。抽滤装置所包含的仪器除减压系统外还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是____。