生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
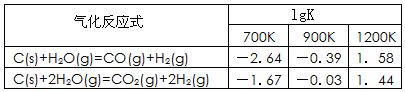
反应:CO(g)+H2O(g) CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2⇌CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
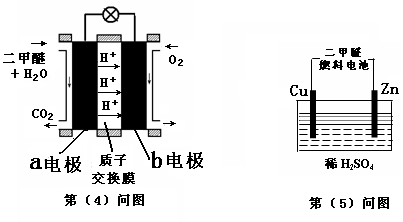
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
(14分)有A、B、C、D、F、G六种短周期主族元素,它们的原子序数依次增大。B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,F元素在地壳中含量居第二位;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z。
请回答下列问题:
G的原子结构示意图为,A2D2电子式为,
BD2的结构式为,Q的分子空间结构为。
(2)固体Z为晶体(填晶体类型),Z中所含化学键类型有。
(3)在D同主族元素氢化物中,Y的沸点反常,原因是。
(4)B、F、G元素非金属性由强到弱的顺序为,若用下图装置验证这三种元素非金属性强弱,则在装置中加入的试剂分别为:Ⅰ,Ⅱ,Ⅲ。(填化学式)
下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为。
(2)反应一段时间后,可观察到B试管中的现象为。
(3)C试管口浸有NaOH溶液的棉团作用是。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |
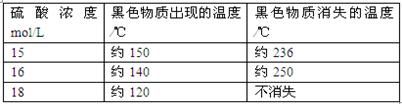 附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 |
X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
仅由上述资料可得出的正确结论是。
A.铜与浓硫酸反应时所涉及的反应可能不止一个 B.硫酸浓度选择适当,可避免最后产物中出现黑色物质;C.该反应发生的条件之一是硫酸浓度≥15 mol·L D.硫酸浓度越大,黑色物质越快出现、越难消失
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 |
反应速率Mg>Fe,Cu不反应 |
金属的性质越活泼,反应速率越快 |
| ②____________ |
反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰D.水
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素。五种元素核电荷数之和为55,对应原子最外层电子数之和为21。W、Z最外层电子数相同,但Z的核电荷数是W的2倍。
(1)Q在周期表中位于第周期族。
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式:。
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式___,该物质所含有的化学键的类型为。
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,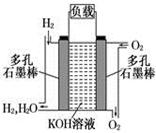
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。电池总离子反应方程式为_______________________________。