有一种纸质软电池,该电池采用薄层纸片作为载体和传导体,一面附着锌,另一面附着二氧化锰。电池总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH),关于此电池,下列说法正确的是
| A.该电池Zn为负极,ZnO为正极,MnO2催化剂] |
| B.该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH- |
| C.放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D.电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动 |
可逆反应A(g)+B(g) 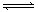 2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的()
2C(g)在固定容积的容器中进行,如果向容器中充入1molA和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1molC,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的()
| A.m>n | B.m<n | C. m=n | D.无法比较 |
今有X(g)+Y(g) 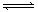 2Z(g)△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的()
2Z(g)△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的()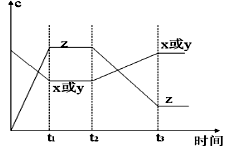
| A.增大X或Y的浓度 | B.增大压强 | C.增大Z的浓度 | D.升高温度 |
高温下,某反应达到平衡,平衡常数K=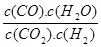 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
下列说法正确的是
| A.放热反应的焓变小于零,熵变大于零 |
| B.放热及熵增加的反应,一定能自发进行 |
| C.放热反应的焓变大于零,熵变小于零 |
| D.放热及熵减小的反应,一定能自发进行 |
在同温、同压下,下列各组热化学方程式中,△H1>△H2的是
| A.2H2O(g) = 2H2(g) + O2(g)△H1 2H2O(l) = 2H2(g) + O2(g)△H2 |
| B.S (g) + O 2(g) = SO2(g)△H1 S (s) + O 2(g) = SO2(g)△H2 |
| C.2C (s) + O 2(g) = 2CO (g)△H1 2C (s) + 2O 2(g) = 2CO2 (g)△H2 |
| D.H2(g) + Cl2(g) = 2HCl(g)△H1 |
2HCl(g) = H2(g) + Cl2(g)△H2