工业上用某矿渣(主要成分为Cu2O,还含有Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
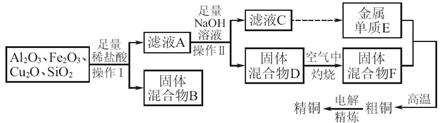
(固体混合物B经处理后可回收铜)
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)实验操作Ⅰ的名称为_________;在空气中灼烧固体混合物D时,用到多种硅酸盐材质的仪器,除玻璃棒、酒精灯、泥三角外,还有_________(填仪器名称)。
(2)滤液A中铁元素的存在形式为_______(填离子符号),生成该离子的离子方程式为_____________________。
检验滤液A中存在该离子的试剂为 (填试剂名称)。
(3)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=_______。
(4) ①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→_____________________ _______→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图: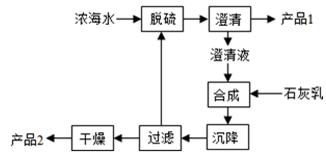
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b.KClO3c.MnO2d.Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
乙酸是食醋的主要成分,它具有以下化学性质:
(1)可使紫色石蕊试液变______色,说明乙酸具有______性。
(2)能发生酯化反应。实验室用下图所示装置制取乙酸乙酯,请写出该反应的化学方程式 。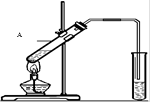
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线: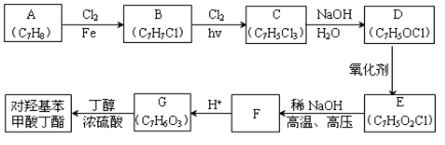
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1。
回答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有 种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是 (写结构简式)。
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下: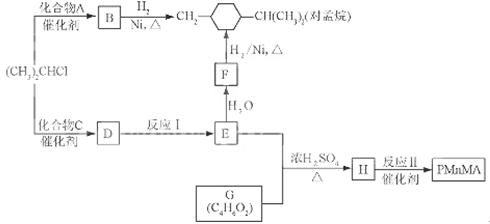
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如: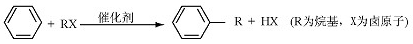
(1)B为芳香烃。
①由B生成对孟烷的反应类型是 。
②(CH3)2CHCl与A生成B的化学方程武是 。
③A的同系物中相对分子质量最小的物质是 。
(2)1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色.
①F的官能团是 。
②C的结构简式是 。
③反应I的化学方程式是 。
(3)下列说法正确的是(选填字母)
a.B可使酸性高锰放钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。G与NaHCO3反应放出CO2。反应II的化学方程式是 。