七种物质回答问题:① 氢氧化钠固体 ② 铜丝 ③ 氯化氢气体 ④ 稀硫酸溶液 ⑤ 二氧化碳气体 ⑥ 蔗糖晶体 ⑦ 熔融氯化钠
属于电解质的是: (填编号,下同),属于非电解质的是 ,能导电的是 。
(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法。制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为 ,整个系统还必须与氧隔绝,其原因是 (用化学方程式表示)
(2)无机非金属材料是日常生活中不可缺少的物质,它们往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为: ,Si3N4属于原子晶体,在上述反应中氧化剂为
,Si3N4属于原子晶体,在上述反应中氧化剂为
(3)硅酸盐中,SiO44-四面体通过共用顶角氧离子可形成链状、层状、空间网状等结构型式。下图为一种无限长双链结构的多硅酸根,其中Si原子的杂化形式为 ,该多硅酸根化学式为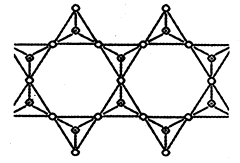
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为 ;
②乙苯的平衡转化率为 ;
③计算此温度下该反应的平衡常数 。
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(3)已知: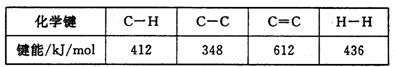
计算上述反应的ΔH= kJ/mol。
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为
已知PbO2与硝酸不反应且氧化性强于硝酸,而PbO是碱性氧化物,能和酸反应,写出上述分解产物与硝酸反应的化学方程式
(2)①另一实验小组也取一定量的PbO2加热得到了一些固体,为探究该固体的组成,取一定质量该固体加入到30 mLCH3COOH一CH3COONa溶液中,再加入足量KI固体,摇荡锥瓶使固体中的PbO2与KI全部反应而溶解,得到棕色溶液。写出PbO2参与该反应的化学方程式 ,用淀粉指示剂,0.2 mol/L的Na2S2O3标准溶液滴定至溶液蓝色刚消失为止, ,Na2S2O3标准溶液的消耗量为20 mL。
,Na2S2O3标准溶液的消耗量为20 mL。
②固体加入到醋酸而非盐酸中是因为会产生有毒气体,写出反应的化学方程式
用CH3COOH一CH3COONa的混合液而不用CH3COOH可以控制pH不至于过低,否则会产生浑浊和气体,请写出该反应的化学方程式
③取相同质量的上述固体与硝酸混合,过滤出的滤液加入足量的铬酸钾溶液得到铬酸铅(PbCrO2相对分子质量323)沉淀,然后 ,得固体质量为0.969g,依据上述数据,该固体的分子式 。
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。
(1)B必须放在冰水浴中控制温度,其原因是 。
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a ;b ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
① Ⅱ中反应的离子方程式是 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式 。
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量 。(填“相同”,“不同”或“无法判断”)