下列各图所表示的实验原理、方法、装置和操作正确的是
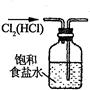


| A.称取NaOH | B.除去Cl2中少量HCl | C.制取氨气 | D.稀释浓H2SO4 |
在下列各溶液中,离子一定能大量共存的是
| A.强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- |
| C.含有0.1 mol·L-1 Ca2+溶液在中:Na+、K+、CO32-、Cl- |
| D.室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |
下列离子方程式书写正确的是
| A.钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| B.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| C.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| D.FeI2溶液中通人少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
下列有关物质的性质、应用等的说法正确的是
| A.SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
| B.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化 |
| C.浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性 |
| D.自来水厂可用明矾对水进行消毒杀菌 |
下列有关化学用语表示正确的是
A.CO2的分子比例模型: |
B.质量数为37的氯原子: |
C.Mg2+结构示意图: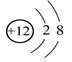 |
D.NH4Cl的电子式: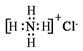 |