下列离子方程式书写正确的是:
| A.碳酸氢钙溶液中加入过量的NaOH溶液: Ca2++HCO3―+OH―=CaCO3↓+H2O |
| B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.FeI2溶液中通入少量Cl2:2 Fe2+ + Cl2="2" Fe3+ + 2Cl- |
| D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰使SO42-沉淀完全NH4++Al3++2Ba2++2SO42-+4OH- =Al(OH)3↓+NH3·H2O+2BaSO4↓ |
下列有关物质性质与应用对应关系错误的是
| A.常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸 |
| B.二氧化硅熔点很高、硬度很大,可用于制造坩埚 |
| C.氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |
| D.金属钠硬度小、密度小,可用于制造高压钠灯 |
25℃时,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+ |
| B.0.1 mol·L-1 FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C.滴入甲基橙显黄色的溶液中: Na+、ClO-、I-、SO42- |
| D.水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、NO3-、CH3COO- |
下列有关化学用语表示正确的是
| A.HClO的结构式:H—Cl—O |
B.羟基的电子式: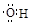 |
| C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- |
| D.异丙醇的结构简式:CH3CH2CH2OH[来 |
下列说法错误的是
| A.使用可降解塑料聚二氧化碳,能减少白色污染 |
| B.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 |
| C.雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 |
| D.通常所说的三大有机合成材料是指塑料、合成纤维、合成橡胶 |
常温下,1L pH=3的H2SO4溶液与下列溶液混合,其说法正确的是
| A.与等体积pH=11的氨水混合后所得溶液pH小于7 |
| B.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| C.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |