海水综合利用的工艺流程图如下:
(l)电解NaCl溶液,在电解槽中可直接得到的产品有H2 、 或H2、 。
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是 。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 ,目的是 ;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由: 。
春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内掀起了魔术表演的热潮。在校园文化节活动中,一位高一年级同学给初中同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜。
(1)魔术一:“奇花变色”
道具如图1所示,该魔术中可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为
色。该魔术中没有涉及的性质是(填字母序号)。
A.氨分子是不断运动的 B.氨分子有一定质量
C.浓氨水具有挥发性 D.氨气的水溶液显碱性
(2)魔术二:“瓶吞鸡蛋”
道具如图2所示,将注射器中NaOH浓溶液注入瓶中,片刻后会看到鸡蛋被“吞”入瓶中。该魔术中涉及的化学反应为 (用化学方程式表示)。
(3)魔术三:“‘清水’变‘牛奶’”
道具如图3所示,当A溶液加到烧杯中,无色溶液变成白色浊液。若A为酸溶液,则A、B的可能组合:A为 ;B为 。(只需写一组)
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇(CH3OH )燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
)燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
(1)这种电极放电时发生的总反应是______________________________________。
(2)此电极的正极发生的电极反应式是__________________________;
负极发生的电极反应式是_______________________________。
(3)电解液中的 离子向_________极(正极或负极)移动;通入正极的气体是________.
离子向_________极(正极或负极)移动;通入正极的气体是________.
写出下列反应的热化学方程式:(6分)
(1) 32.5g锌在氧气中完全燃烧生成氧化锌固体,放出175KJ的热量。
。
(2) 氢气与碘蒸气反应,生成1molHI气体时,吸收25.9KJ的热量;
。
甲、乙两个容器中,分别加入0.1mol/L NaCl溶液与0.1mol/L AgNO3溶液后,以Pt为电极进行电解时, (14分)
(14分)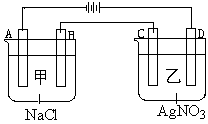
(1)写出电极名称和电极反应式:
A
B
C
D
(2)在A、D电极上生成的气体物质的量之比为:_____________
已知在29 8K时的热化学反应方程式:(3分)
8K时的热化学反应方程式:(3分)
C(s,石墨)+O2(g)=CO2(g);△H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g);△H2=-566.0kJ/mol。
则298K时,反应 C(s,石墨)+1/2 O2(g) =" CO" (g)的△H是______________