已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。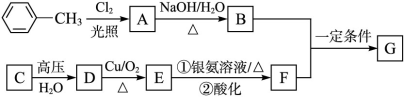
(1)G的结构简式为__________。
(2)指出下列反应的反应类型:A转化为B:______,C转化为D:__________。
(3)写出下列反应的化学方程式:
D生成E的化学方程式:________________________。
B与F生成G的化学方程式:____________________。
(4)符合下列条件的G的同分异构体数目有____种:①苯环上有3个取代基,且有两个取代基相同;②能够与新制的银氨溶液反应产生光亮的银镜。其中氢原子共有四种不同环境的所有物质的结构简式为__________、____________。
I.已知碳酸锂在水中的溶解度很小且随温度升高而减小,现用Na2CO3溶液和Li2SO4溶液制Li2CO3。
(1)Na2CO3溶液中离子浓度由大到小的顺序为。
(2)写出制备Li2CO3的化学方程式。
(3)获得Li2CO3的最佳方法是将反应后的物质。
a.静置、过滤 b.加热后,趁热过滤 c.蒸发浓缩、冷却结晶
II.可逆反应①A(g)+2B(g) 2C(g)②2E(g)
2C(g)②2E(g) F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
(4)反应①是反应(填“放热”或“吸热”)。
(5)达到平衡I时,体系压强与反应开始时体系压强之比为。
(6)平衡I和平衡II中,E的体积分数(填“相等”、“不相等”、“无法确定”)。
(7)达平衡I时,计算A的转化率(用分数表示)。
(13分)请正确书写下列方程式。
(1)乙烯与溴水的反应。
(2)丙烯与HCl的反应(遵循马氏规则)。
(3)乙烷与氯气生成一氯乙烷的反应____________________,反应类型为________反应。
(4)写出由乙炔生产聚氯乙烯合成树脂所涉及的两个有机化学反应方程式,并且指明所属类型。
①____________________________________,反应类型为________反应;
②____________________________________,反应类型为________反应。
(12分) 按要求填空。
(1)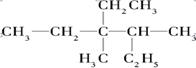 的系统名称是__________。
的系统名称是__________。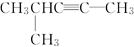 (2)HC≡CCH2CH(CH3)2系统命名为_______________。
(2)HC≡CCH2CH(CH3)2系统命名为_______________。
(3)2,4二甲基己烷的结构简式为。
(4)3-甲基-1-丁烯的键线式。
(5)某高聚物的结构简式如图所示,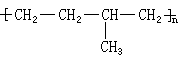
形成该高聚物的单体的结构简式分别为 、。
维生素C的结构简式如图所示: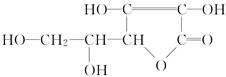
(1)维生素C的分子式为:______________。
(2)写出分子中官能团的结构简式和名称。、、。
(5分)有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C.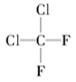 与 与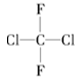 |
| D.乙烯与1—丁烯 |
E.己烷与2,3—二甲基丁烷
以上各组物质属于同位素的是________;属于同素异形体的是________;属于同系物的是________;属于同分异构体的是________;属于同一物质的是________。